¿Cuáles son las aportaciones del trabajo de investigación de Linus Pauling?
Valoración de la comunidad:
Última Actualización:
6 de Febrero de 2025 a las 17:12¿Cuáles son las aportaciones del trabajo de investigación de Linus Pauling?
Aprendizaje esperado: argumenta los aportes realizados por Pauling al análisis y sistematización de resultados en la tabla de electronegatividad.
Énfasis: reconocer la importancia del trabajo realizado por Pauling al proponer la tabla de electronegatividad y explicar la formación de compuestos.
¿Qué vamos a aprender?
Enfatizarás que la investigación es el proceso por el cual buscas de forma sistemática la solución a un problema o la respuesta a algo que desconoces. La importancia de la investigación radica en que ésta ha sido un instrumento clave para el progreso de la humanidad.
Lee la siguiente frase célebre de Linus Pauling:
“La ciencia es la búsqueda de la verdad, que es el esfuerzo por entender el mundo: implica el rechazo de prejuicios, de dogmas, de la revelación, pero no el rechazo de la moral”.
Los temas que se estudiarán durante esta sesión son:
- Aportaciones de Pauling a la ciencia y a la humanidad
- Electronegatividad
- Enlaces químicos
- Uso de la tabla de electronegatividad
El propósito de esta sesión es reconocer la importancia del trabajo realizado por Pauling quien propuso la tabla de electronegatividad y explicar la formación de compuestos.
En esta sesión reconocerás las aportaciones de Linus Pauling en la ciencia y también como activista.
También recordarás algunos temas de sesiones anteriores como enlaces químicos, tipos de enlace, electronegatividad y regularidades de la tabla periódica.
Finalmente aprenderás la importancia de conocer los valores de la tabla de electronegatividad para reconocer el tipo de enlace de los compuestos químicos.
Ocuparás tu libro de texto, tu cuaderno de ciencias, bolígrafo, lápiz y colores.
¿Qué hacemos?
Debido a las circunstancias de salud actuales, conceptos básicos, pero poco frecuentes en tu entorno diario, han ganado importancia. Como sabes, uno de los elementos más importantes es el oxígeno, que es empleado como tratamiento terapéutico.
“¿Sabías que?”
La oxigenoterapia es un tratamiento para la oxigenación pulmonar. El oxígeno es esencial para el funcionamiento celular. Una oxigenación insuficiente conduce a la destrucción celular y desgraciadamente puede llegar a la muerte de una persona. Los órganos más susceptibles a la falta de oxígeno son el cerebro, las glándulas suprarrenales, el corazón, los riñones y el hígado.
- Video:
(del minuto 03:41 al minuto 03:50)
https://youtu.be/v8OtdtDAx5s
El oxígeno es el tercer elemento más abundante en el Universo, después del hidrógeno y del helio.
Es generado principalmente en el interior de las estrellas más grandes, y se incorpora al medio interestelar cuando éstas finalmente explotan como supernovas.
Primero por medio de la formación y evolución de generaciones sucesivas de estrellas masivas, el hidrógeno y el helio primigenio se van transformando en oxígeno y otros elementos pesados.
A pesar de que el oxígeno es común en el Universo, el oxígeno diatómico presente en los planetas que conoces es en general muy raro. El planeta Tierra, sin embargo, es una excepción evidente. En la atmósfera terrestre, las moléculas de oxígeno, O2 constituyen casi el 21% de su volumen total, y es producto de la oxidación del H2O que se lleva a cabo en el fotosistema II de las plantas, algas y cianobacterias.
Actualmente, el oxígeno es innegablemente necesario para sostener gran parte de la vida terrestre. Se encuentra en la atmósfera no sólo en su forma respirable (como molécula diatómica O2), sino también como ozono (O3), que es importante para defender a los seres vivos de las radiaciones ultravioleta del Sol.
El oxígeno es indispensable para la mayoría de los seres vivos debido a que es el aceptor final de electrones en la cadena respiratoria y dicho transporte está acoplado a la síntesis de ATP. Es decir, contribuye a la obtención de la energía necesaria para la realización de las actividades de las células y de los organismos.
Observa el fragmento del siguiente video del inicio al segundo 00:23, para comprender mejor por qué es importante el oxígeno en la respiración. - El aliento de la vida
https://youtu.be/hTqqEMiIPqc
(del minuto 05:50 al minuto 06:12)
https://youtu.be/v8OtdtDAx5s
Como observaste, la respiración forma parte de la nutrición ya que el oxígeno permite la obtención de energía de los alimentos.
Continúa observando el video del segundo 00:49 a 2:08. - El aliento de la vida
https://youtu.be/hTqqEMiIPqc
(del minuto 06:27 al minuto 07:47)
https://youtu.be/v8OtdtDAx5s
Cómo pudiste distinguir, en la respiración intervienen elementos químicos presentes en la vida cotidiana, que son imprescindibles para llevar a cabo las funciones.
Una de las investigaciones que realizó Pauling fue acerca de la vitamina C, también conocida como ácido ascórbico, donde concluyó que una determinada dosis al día de esta vitamina ayuda al cuerpo contra la gripe y otras enfermedades respiratorias.
Actualmente sabes que la vitamina C contribuye a la función adecuada del sistema inmune y también que su consumo se ha asociado con una mejor función pulmonar.
Linus Pauling fue un gran científico, porque sus estudios abarcan varios campos de la ciencia y fue un gran activista.
A lo largo de su vida publicó más de 600 artículos; fue doctor Honoris Causa de 40 universidades, millones de universitarios en todo el mundo han estudiado sus libros y hasta la fecha es el único científico en ganar 2 premios Nobel sin compartirlos con otro u otros científicos en áreas completamente distintas. Ganador, en 1954, del premio Nobel de Química y en 1962, del premio Nobel de la Paz. Ha sido incluido en la lista de los 20 científicos más importantes de la humanidad junto a Einstein, Pasteur, Newton y da Vinci, entre otros.
Pauling quería estudiar un doctorado en la Universidad de Berkeley donde Gilbert Newton Lewis, personaje admirado por él, investigaba el enlace químico, pero al no entrar a Berkeley realizó sus estudios en el CalTech, que en esa época se convirtió en uno de los centros de investigación científica más grande del mundo ya que lo visitaban importantes científicos como Sommerfield, Bohr y Einstein.
Sus pláticas y conferencias eran discusiones científicas de alto nivel y Pauling aprendió de ellos, también durante una estancia en Europa, en la cual trabajó junto a grandes científicos sobre la nueva mecánica cuántica y justamente recordando los trabajos de Lewis, lo aplicó a la química creando un poderoso lenguaje que hoy se sigue utilizando.
En 1931, Pauling escribió un artículo de 34 páginas titulado “La naturaleza del enlace químico” que lo haría famoso, en estas páginas se encontraba todo lo que él sabía sobre la estructura del átomo y las moléculas, asimismo, que las propiedades de las moléculas dependían de sus enlaces.
Pauling se vuelve un activista reuniendo firmas por todo el mundo para suspender las pruebas de explosiones nucleares en la atmósfera. Presentó una conferencia titulada La ciencia en el mundo moderno, donde habló sobre los peligros de las bombas atómicas y de la radiación que producen.
Solicitó públicamente la terminación de las pruebas atómicas y el 10 de octubre de 1963 la ex Unión Soviética, Inglaterra y Estados Unidos firmaron el acuerdo que limitaba las pruebas de armas nucleares a cielo abierto, ese mismo día se le otorgó a Pauling el premio Nobel de la Paz, necesitó 7 años de campaña y miles de firmas, entrevistas y citas con autoridades para que ese acuerdo se concretara.
Pauling también trabajó en la descripción de la estructura helicoidal de las proteínas, la estructura del ácido desoxirribonucleico ADN y cuando estaba dando una conferencia en 1954 sobre la hemoglobina, recibió una llamada donde le avisaron que había recibido el Premio Nobel de Química por su trabajo acerca del enlace químico y la estructura de las moléculas.
Para la década de los 70’s, Pauling había concebido el concepto de medicina orto molecular, en donde se tratan las enfermedades haciendo variar las concentraciones en el cuerpo humano de sustancias que se hallan presentes en el mismo y que son precisas para la salud, este concepto lo llevó a trabajar sobre el metabolismo de los humanos con mucha precisión, por eso la publicación de su libro “Vitamina C, resfriado común y gripe” causó una importante conmoción en el mundo de la medicina.
El científico inglés Francis Crick bautiza a Pauling como el mejor químico del mundo. - Video:
(del minuto 13:24 al minuto 13:38)
La función del sistema respiratorio del cuerpo humano es enviar oxígeno en cantidad suficiente a los tejidos para que puedan realizar de forma adecuada las funciones para las que están diseñados, por ejemplo, los músculos para poder contraerse y mover el cuerpo.
La sangre contiene a los glóbulos rojos, que a su vez contienen hemoglobina, una proteína responsable de transportar el oxígeno a todos los tejidos.
Para la medición de los niveles de oxígeno en la sangre se utiliza un aparato no invasivo muy fácil de utilizar.
La saturación del oxígeno es la medida que informa cómo los glóbulos rojos están transportando oxígeno, es decir, si después de pasar por los pulmones ha sido capaz de captar moléculas de oxígeno. Como ejemplo, si el glóbulo rojo fuera una camioneta y el oxígeno los pasajeros que puede llevar, identificarías cuántos pasajeros lleva esa camioneta.
Aunque la saturación de oxígeno solo da un estimado, te permite reconocer los niveles de oxígeno en la sangre por medio de un porcentaje, metafóricamente, cuántos pasajeros viajan en la camioneta y por ello se pueden reconocer valores que se pueden considerar normales y/o bajos.
El oxímetro es capaz de estimar la cantidad de oxígeno en la sangre gracias a que, al colocarse en el dedo, detecta cambios en la absorción de luz mediante un haz que pasa a través del dedo.
Con este sencillo aparato puedes determinar si existe hipoxia en una persona. La hipoxia es la disminución de oxígeno disponible en las células del organismo, produciendo alteraciones en su funcionamiento normal.
Para ello, un dato importante son los valores de saturación del oxígeno en la sangre. El rango normal oscila entre el 95% y 100%, la hipoxia leve entre el 91% al 94%, la hipoxia moderada entre el 86% al 90%, y se considera hipoxia grave cuando los valores están por debajo del 85% de saturación de oxígeno.
Por cierto, el agujero de la capa de ozono se cerró en abril, tras el aumento de las temperaturas en la estratósfera que culminó con una entrada de aire rico en ozono procedente de la atmósfera inferior.
El ozono es un gas formado por tres átomos de oxígeno, ¿cómo se unen los átomos? Por medio de enlaces, recuerda que los enlaces químicos, constituyen la unión de las moléculas y átomos para producir nuevos compuestos químicos, ofreciéndoles estabilidad.
Es mediante este proceso, donde dichos elementos (átomos y moléculas) cambian sus propiedades, tanto químicas como físicas. Además, como producto de ello, se originan nuevas sustancias.
Los enlaces químicos se forman compartiendo electrones para alcanzar configuraciones electrónicas estables como las de los gases nobles.
Los átomos electropositivos ceden electrones hasta completar la configuración más estable, por ello quedan con carga positiva. Los elementos electronegativos por su parte capturan electrones y quedan con carga negativa.
Existen diferentes tipos de enlaces en los que los átomos pueden transferir o compartir sus electrones de valencia.
En el caso extremo en que uno o más átomos pierden electrones, y otros átomos los ganan con el fin de producir una configuración de electrones de gas noble, el enlace se denomina enlace iónico.
El enlace covalente es la unión química entre dos átomos que comparten electrones. Esto hace que los átomos se comporten como una unidad que llamamos molécula.
Los átomos interactúan entre sí por medio de los electrones más externos o de valencia formando enlaces.
La tabla de electronegatividad te ayuda a identificar la capacidad de atracción que ejerce un elemento sobre los electrones en un enlace químico. La electronegatividad de los átomos de un elemento es responsable de que la densidad electrónica a su alrededor sea más o menos elevada.
La escala de Linus Pauling es uno de los métodos más utilizados. Observa la tabla periódica de electronegatividad, en ella detectarán la variación de la electronegatividad. Como puedes identificar, ésta va aumentando de izquierda a derecha a lo largo de los periodos, y de abajo hacia arriba dentro de cada grupo.
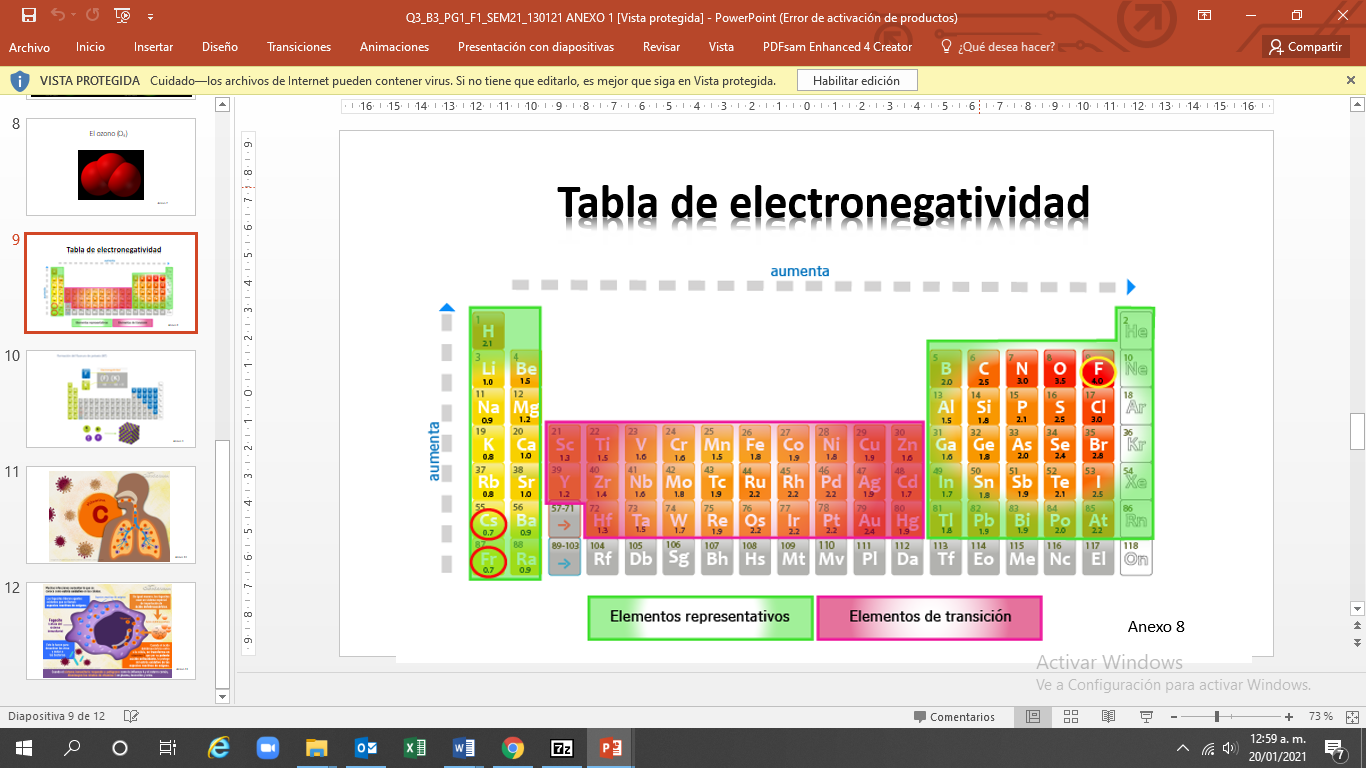
Es necesario aclarar que los valores de electronegatividad fueron asignados con base en una escala arbitraria denominada escala Pauling. El elemento que presenta el valor más alto (mayor electronegatividad) es el Flúor (F) con 4 unidades Pauling, mientras que los valores más bajos (menor electronegatividad) corresponden al Cesio (Cs) y al Francio (Fr) con 0.7 unidades Pauling.
Ahora, observa el uso de la tabla de electronegatividad para comprender un enlace iónico, como la formación de fluoruro de potasio, por ejemplo.

En este compuesto es posible analizar la atracción de ambos elementos, y la estructura química que forman. Así como la diferencia de electronegatividad, que para este ejemplo se obtiene mediante la siguiente operación 4.0-0.8= da como resultado 3.2.
Este valor, cercano a 4, indica la formación de un enlace iónico.
Realiza la siguiente actividad: Investiga 4 ejemplos más de enlaces químicos, iónicos o covalentes, e identifica cuál es la diferencia de electronegatividad entre los elementos que participan. Si te es posible, comparte tus resultados con tu maestra o maestro
Ahora observa el siguiente diagrama:

Durante esta sesión conociste las aportaciones que realizó Linus Pauling a la química, medicina y sobre la conciencia social que tenía. Un hombre que hasta nuestros días se encuentra presente gracias a sus estudios y aportaciones.
La tabla de electronegatividad que desarrolló te permite reconocer los enlaces de las moléculas de elementos, así como de los compuestos iónicos y moleculares.
Durante la actual pandemia de COVID-19 que azota al mundo, muchas personas han hecho compras masivas de vitamina C pensando que podría servirles contra el coronavirus que la provoca. ¿Realmente existe información científica que apoye el consumo de esta vitamina en casos de enfermedades respiratorias graves?
La doctora Armida Báez Saldaña, investigadora del departamento de Biología Celular y Fisiología del Instituto de Investigaciones Biomédicas de la UNAM, recuerda que en la literatura antigua el escorbuto estaba asociado con la neumonía como causa terminal en estos enfermos.
Aunque en nuestros días el escorbuto es raro, en la antigüedad era frecuente entre marineros a partir de dos o tres meses de estar en altamar. El escorbuto es una enfermedad justamente provocada por la deficiencia de vitamina C.
La vitamina C o ácido ascórbico fue aislada por primera vez en 1928 por Albert Szent-Gyorgy, quién también demostró su propiedad antiescorbútica en 1932. En 1953 James Lind descubrió la cura del escorbuto por medio del consumo de frutos cítricos.
En el sistema inmunitario: Muchas infecciones aumentan lo que se conoce como estrés oxidativo, refiere la investigadora.
Lo anterior ocurre como parte de este proceso debido a que los fagocitos, unas células del sistema inmunitario que se encuentran en la sangre, liberan agentes oxidantes llamados especies reactivas de oxígeno.
Esto lo hacen para desactivar a los virus y matar a las bacterias. A la vez, los fagocitos usan un sistema especial de importación de ácido dehidroascórbico, que es una forma oxidada de la vitamina C.
Cuando el ácido dehidroascórbico entra a la célula, se transforma en vitamina C y la protege gracias a su potente acción antioxidante.
Cuando el sistema inmunitario responde a patógenos como la influenza A y el catarro común, disminuyen los niveles de vitamina C en plasma, leucocitos y orina. Estos efectos han llevado a que algunos médicos receten esta vitamina a las personas con catarro común o influenza, evitando que se reduzcan sus niveles en los leucocitos y en el plasma.
Existen numerosos coronavirus que provocan gripa o catarro común. El nuevo coronavirus SARS-CoV-2, causante de la infección COVID-19, está compuesto por una cadena de ARN envuelta por una bicapa lipídica, en cuya superficie tiene distintas proteínas, entre las que se encuentra una proteína que se une a la proteína llamada ACE2 existente en las células de varios órganos, entre ellos el tracto digestivo, los riñones, el corazón y los pulmones, principalmente. Dicha unión permite el ingreso del RNA viral a las células y el contagio por el SARS-CoV-2
Existe en la literatura científica evidencia del efecto protector de altas dosis de vitamina C intravenosa, en experimentos de sepsis (fuerte infección en la sangre que provoca falla multiorgánica) inducida. Administrada vía intravenosa, la vitamina C ayuda a mantener la barrera epitelial alveolar y a reducir la actividad de los neutrófilos que producen inflamación sistémica provocada por la sepsis.
El reto de hoy:
Al respecto, se te sugiere leer algunos artículos de la UNAM en los siguientes enlaces:
- http://www.comoves.unam.mx/numeros/rafagas/97
- http://www.revistas.unam.mx/index.php/req/article/view/66738
- http://www.revistas.unam.mx/index.php/req/article/view/64438
- http://www.scielo.org.mx/scielo.php?script=sci_arttext&pid=S0187-893X2011000100007
¡Buen trabajo!
Gracias por tu esfuerzo.
Para saber más:
Lecturas



Login to join the discussion