¿Cuáles reacciones de óxido-reducción identifico en mi entorno?
Valoración de la comunidad:
Última Actualización:
6 de Febrero de 2025 a las 17:12
¿Cuáles reacciones de óxido-reducción identifico en mi entorno?
Aprendizaje esperado: identifica el cambio químico en algunos ejemplos de reacciones de óxido-reducción en actividades experimentales y en su entorno.
Énfasis: reconocer el cambio químico en algunos ejemplos de reacciones de óxido-reducción en su entorno.
¿Qué vamos a aprender?
Actualmente, se considera que las reacciones óxido reducción conocidas como reacciones redox, ocurren cuando hay una transferencia de electrones entre átomos de sustancias diferentes.
De tal forma que mientras una sustancia pierde electrones, otra sustancia los gana ¿Cuáles puedes identificar en tu entorno?
Ten a la mano tu cuaderno, y tu bolígrafo y consulta tu libro de texto.
Lee la siguiente frase célebre de Carl Sagan en la serie cosmos:
“La belleza de algo no radica en su composición atómica, sino en cómo están organizados dichos átomos”.
Somos la prueba de cómo el universo a través del tiempo puede alcanzar ese estado de perfección en su organización, desde su escala más fundamental.
¿Qué hacemos?
Comienza con el segmento del clima. La presencia de óxidos de azufre y los óxidos de nitrógeno, compuestos químicos generados a partir de la quema de combustibles fósiles o por emisiones volcánicas y fuentes termales, se combinan con eventos meteorológicos, como los vientos, la precipitación y la radiación solar, además de la condensación del vapor del agua.
Como consecuencia, se produce un evento denominado lluvia ácida que se forma por la presencia de dióxido de azufre, el cual se oxida es decir pierde electrones, generando trióxido de azufre (SO3), y al reaccionar con el agua se origina el ácido sulfúrico (H2SO4).
Puedes observar las consecuencias de este fenómeno en la corrosión de construcciones como las que están hechas de mármol.
Investiga las respuestas de las siguientes preguntas y anótalas en tu cuaderno.
¿Qué pH tiene la lluvia ácida? ¿Qué consecuencias puede tener para el ambiente y los seres vivos? ¿Qué medidas tienes que tomar para evitar la acidificación del agua?
Q3_B4_PG1_SEM27
(del minuto 03:02 al minuto 03:48)
Por otro lado, debes procurar una dieta saludable y el limón es un producto que evitará que se oxiden tus alimentos, solo agrega unas gotas, por ejemplo, a un guacamole y así evitaras que se oxide, es decir, que se ponga negro.
¿Sabes preparar un guacamole?
Los ingredientes son tortillas, jitomate picado, cebolla finamente picada, un poco de chile serrano también finamente picado y aguacate y haces una mezcla heterogénea.
Para que no se oxide agrega unas gotas de limón al guacamole, ya que éste evitará que se oxide.
La oxidación es una reacción que se lleva a cabo en la fruta al contacto con el oxígeno del aire, la cual desencadena la degradación de los compuestos fenólicos.
Entonces, los fenoles reaccionan con el oxígeno y ocurre el cambio químico porque se forman quinonas, que crean pigmentos marrones, rojos y negros.
Recuerda lavarte perfectamente tus manos al preparar alimentos y al consumirlos.
Lee la siguiente historia en el segmento de la ciudad:
Una persona alcoholizada al ser detenida se rehusó a que le hicieran la prueba del alcoholímetro argumentando que estaba adulterada. Por ello, el oficial lo remitió al torito más cercano.
Acusado de calumnias y faltas al alcoholímetro, dijo que las reacciones de óxido-reducción ocurren entre una disolución de dicromato de potasio (agente oxidante) con el alcohol. El alcohol se oxida hasta transformarse en aldehído.
Se evidencia la reacción por el cambio de color.
El infractor salió libre pagando la multa correspondiente, le pidieron que no volviera a consumir alcohol para beneficio de su salud y además, lo mandaron a estudiar química para conocer que en las reacciones óxido reducción siempre hay un átomo que se oxida y un átomo que se reduce.
En las reacciones redox hay una transferencia de electrones entre los reactivos. Los átomos del elemento que pierde electrones se oxida y los átomos del elemento que gana electrones se reduce.
Q3_B4_PG1_SEM27
(del minuto 06:43 al minuto 06:51)
Con respecto a información educativa, esta recomendación tiene como finalidad que los identifiques procesos de óxido reducción que de manera constante suceden a tu alrededor.
Podrás utilizar la técnica SQA.

Al inicio del tema puedes llenar las dos primeras columnas (que sé y qué quiero aprender) y al final puedes regresar a responder la última columna. Esto puede ayudar a que identifiques de manera puntual aquellos conocimientos que adquirieron en una sesión.
Ahora pasa al segmento de salud donde se responderán las siguientes incógnitas:
- ¿Qué son los radicales libres?
- ¿Cuáles son las causas del envejecimiento?
- Analiza la teoría del envejecimiento por oxidación.
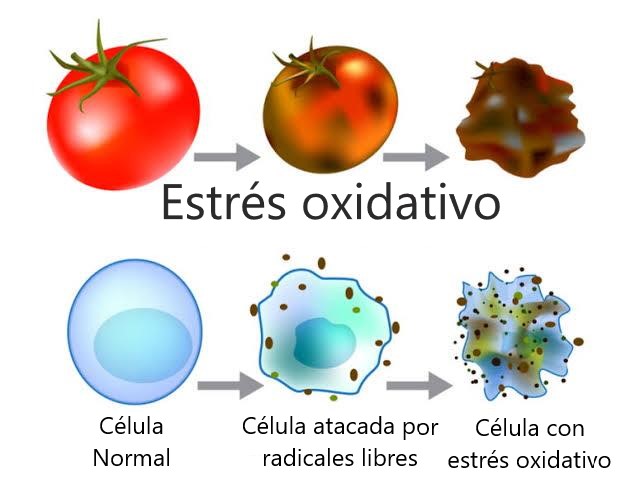
Seguramente has escuchado eso de los radicales libres y algunas implicaciones que pueden tener en la salud.
Los radicales libres son moléculas que tienen un electrón libre en su capa de valencia, lo que hace que sean muy reactivas. Es decir, pueden reaccionar con otras moléculas tomando un electrón de ellas y, por lo tanto, oxidándolas, generando otras moléculas que reaccionan igual. Es decir, se genera una reacción en cadena que permite el incremento de radicales libres.
Por otro lado, todas las células requieren de la energía producida por la oxidación de la glucosa en presencia de oxígeno.
Como parte de este proceso natural, necesario y muy importante para las células, se generan radicales libres y aunque las células tienen manera de protegerse de ellos, distintos factores pueden favorecer el incremento de estos radicales libres. A esto se le conoce como estrés oxidativo y se le ha asociado con el envejecimiento celular.
Factores como fumar, una mala alimentación y la radiación solar o la contaminación pueden favorecer el incremento de radicales libres y por lo tanto el estrés oxidativo.
Afortunadamente el cuerpo puede fabricar por sí mismo ciertos antioxidantes, que podrían no ser los suficientes, por lo que la mayoría se aportan externamente por medio de la alimentación.
Las células están compuestas por una serie de moléculas con átomos unidos por enlaces químicos.
Cuando los electrones de un átomo quedan desapareados se producen los radicales libres que no son más que una molécula inestable que ha perdido electrones.
Como el cuerpo siempre tiende a recuperar el equilibrio, esa molécula buscará el electrón que necesita en otra, que a su vez se convertirá en un radical libre y así sucesivamente.
De este modo comienza el estrés oxidativo que acaba oxidando y por lo tanto dañando a las células. Se dice que eso es un daño porque una molécula dentro de las células al ser oxidada cambia y eso afecta su función dentro de la célula.
Por ejemplo, la membrana de la célula tiende a endurecerse con la oxidación, lo cual hace que los nutrimentos no puedan pasar correctamente, también puede dañar al ADN y afectar su capacidad de repararse adecuadamente.
Igualmente, los receptores que se encuentran en la membrana dejan de reconocer eficazmente las hormonas y neurotransmisores. Como puedes darte cuenta, varios de estos cambios, son debido a la oxidación por la acción de radicales libres, por lo que afectan funciones celulares. Por esta razón, varios de los efectos de los radicales libres se han asociado con el envejecimiento.
Q3_B4_PG1_SEM27
(del minuto 10:36 al minuto 10:44)
El consumir alimentos antioxidantes es benéfico para la salud porque éstos ayudan a frenar el proceso de formación de radicales libres y retarda el envejecimiento.
Los frutos rojos, frutos secos, té verde, uvas, son ejemplos de alimentos antioxidante, son económicos y los puedes conseguir fácilmente. Solo tienes que incluirlos en tu dieta o alimentación diaria ya que son ricos en vitaminas C y E.
Continúa con el segmento internacional. Fue detectado el causante de afectar gran parte de la materia prima y los equipos utilizados en la industria.
Por muchos años ha estado afectando a la industria. Ya que modifica las propiedades de los metales.
Su material preferido: Los metales como el hierro y el acero.
Modo de operación: Desgasta paulatinamente a los metales por medio de reacciones “oxido-reducción”
Preferentemente utiliza al oxígeno para su ataque, aunque a veces utiliza al agua.
Los científicos lo han llamado “Corrosión”
Lo han definido como el deterioro de un material a causa de un ataque electroquímico por su entorno.
Siempre que la corrosión esté originada por una reacción electroquímica: óxido-reducción. La velocidad a la que tiene lugar dependerá en alguna medida de la temperatura, de la salinidad del fluido en contacto con el metal y de las propiedades de los metales en cuestión.
Las evidencias de la corrosión son las alteraciones producidas en la estructura química del metal:
En el hierro y el acero deja rastros de una sustancia color marrón, pierde dureza y puede llegar a romperse. En el cobre deja una coloración verde-negruzca. La corrosión es un problema que afecta directamente a las industrias.
Afortunadamente se puede detectar a tiempo y prever accidentes tomando las medidas pertinentes.
Con respecto del segmento de espectáculos, lee el siguiente texto:
La primera gran actriz Cesia tuvo un enfrentamiento en los camerinos de los foros de Aprende en Casa 3 con la también primera actriz Rubidia.
Todo empezó cuando Cesia al ver a Rubidia le dijo que qué bonita oxidada traía en el cabello.
Rubidia no se quedó callada y le dijo que estaba toda reducida.
Esto no hubiera sucedido si Cesia hubiera sabido que se lo dijo en términos químicos ya que la coloración del cabello, también denominada coloración de oxidación proporciona una modificación permanente del color natural del cabello.
En general, los tintes para el cabello se componen de: un agente oxidante (peróxido de hidrógeno) y un agente alcalino (amoniaco) que permite la decoloración y la absorción del pigmento.
Pero la discusión llegó a buenos términos, ya que Rubidia recordó que la sustancia que se oxida se denomina agente reductor y la sustancia que se reduce recibe el nombre de agente oxidante. Rubidia y Cesia siguieron trabajando juntas haciendo redox, por mucho tiempo.
En el segmento económico. En México no se tienen cifras tan precisas en cuanto a las pérdidas económicas producto de la corrosión.
Se podría hablar de una pérdida por corrosión de entre 28.5 y 38.1 billones de dólares anuales.
Es por ello por lo que se deben tomar las medidas necesarias para que no afecte su economía.
Por otro lado, en la bolsa de valores llamada reacciones químicas.
Los agentes reductores pierden electrones, por lo tanto, se oxidaron.
En tanto, los agentes oxidantes ganaron electrones y en consecuencia se reducen.
En el segmento deportivo: en el primer tour ciclístico de “Dalton” el ciclista de apellido Fierro, sufrió una aparatosa caída.
Al ir a toda velocidad y al hacer virar su bicicleta en el kilómetro uno, notó que su bicicleta iba dejando un rastro de un polvo marrón.
Él se había preparado físicamente, pero al no tener dinero para comprar una bicicleta nueva, y por las prisas, tomó la bicicleta que tenía en el patio de su casa, lo que culminó en su estrepitosa caída al romperse a la mitad su bicicleta.
Afortunadamente solo sufrió raspones y moretones y obviamente no pudo seguir en la competencia.
¿Qué fue lo que originó esta derrota deportiva? La corrosión.
Los materiales de los cuales están constituidas las bicicletas es de hierro, cuando el deportista la dejó a la intemperie, el hierro reaccionó con el oxígeno del aire.
¿Qué ocurrió submicroscópicamente?
El hierro perdió electrones, es decir se oxidó y el oxígeno del aire ganó electrones, en consecuencia, se redujo, por lo que se generó óxido de hierro Fe2O3.
Esto se hubiera evitado si el ciclista se hubiera percatado del polvo color marrón que tenía la vieja bicicleta.
Ahora el ciclista se ha comprado una bicicleta de bambú. Las partes metálicas las ha cubierto de esmalte anticorrosión, además, promete no volverla a dejar a la intemperie y evitar que se moje.
La lata no se corroe porque está cubierta, porque está hecha de estaño y rociada de plástico en su interior.
Las latas están hechas como otros objetos de hojalata y cubiertas con una fina capa de estaño, lo cual no permite que llegue el oxígeno al interior y que entre en contacto con el metal.
En cambio, las latas de aluminio se encuentran ya oxidadas.
¿Qué ocurre submicroscópicamente?
En cuanto entra el aluminio en contacto con el oxígeno se oxida. Lo correcto es decir “el aluminio siempre está cubierto de óxido, y no el aluminio se oxida”. Esa capa de óxido transparente hace que no se vea afectado por los elementos del ambiente exterior.
¿Alguna vez te has preguntado por qué no se oxidan los utensilios de acero inoxidable?
El acero inoxidable se compone de hierro, cromo, manganeso, silicio, carbono. Todos estos reaccionan con el oxígeno del agua y del aire, formando una película muy fina.
Esta barrera que defiende contra la corrosión de óxidos metálicos y los hidróxidos.
Continua con el segmento de la naturaleza.
Q3_B4_PG1_SEM27
(del minuto 18:59 al minuto 19:06)
Aprenderás las reacciones químicas de bioluminiscencia de las luciérnagas.
Las luciérnagas producen luz con la finalidad de atraer a una posible pareja para aparearse.
En el abdomen tienen un órgano que produce una sustancia llamada luciferina que, al combinarse con el oxígeno, origina una reacción de tipo redox, emitiendo energía luminosa.
La reacción química directa de la luciferina es muy lenta y produce poca luz.
La luciérnaga produce, además, una enzima denominada luciferasa, que cataliza la reacción, es decir, la acelera.
En el segmento Histórico.
En 1718 Georg Stahl propuso la existencia del “Flogisto” para explicar la combustión.
Cuando un óxido se calienta en presencia del carbono absorben de la atmósfera el flogisto y al hacer combustión lo liberan.
1772 Louis-Bernand Guyton Monveau postula y demuestra que los metales ganan peso durante la combustión.
Esta teoría fue rebatida a finales del siglo XVIII, cuando el químico y biólogo Antoine-Laurent Lavoisier, conocido por sus estudios sobre la oxidación de los metales o la ley de la conservación de la materia.
Demostró que la combustión era producto de una reacción química. Gracias a Antoine-Laurent Lavoisier se sabe que:
La combustión es una reacción en la que se desprenden cantidades apreciables de energía, en formas de luz, calor y fuego.
En la combustión intervienen dos tipos de sustancias: un combustible y un comburente.
La combustión inicia con la generación de una chispa para producir la flama. El carbono del butano pierde electrones que se transfieren al oxígeno, al perder electrones se oxida, al oxidarse, actúa como agente reductor.
El oxígeno que está presente en el aire recibe los electrones del carbono, se reduce al ganar electrones y al reducirse, actúa como agente oxidante.
Recapitula: Observaste que los metales se oxidan al estar a la intemperie debido a las reacciones oxido-reducción.
Estas ocurren cuando hay una transferencia de electrones entre átomos de sustancias diferentes.
Las reacciones de óxido-reducción también llamadas redox tienen las siguientes características.
Las sustancias que pierden electrones se oxidan y se conocen como agente reductor.
Las sustancias que ganan electrones se reducen y reciben el nombre de agente oxidante.
La corrosión es un proceso asociado al deterioro de los materiales, que es causado por exponerse a un ambiente químico. Se presenta tanto en metales como en cerámicas y es favorecido por factores ambientales como la humedad, el oxígeno del aire, altas temperaturas y a las propiedades del metal.
Las reacciones de óxido reducción son parte de nuestra vida diaria. Abarcan los procesos de combustión, la generación de energía eléctrica. Acción de blanqueadores de ropa, producción de fuegos artificiales, la acción de antisépticos, conservadores y desinfectantes.
El reto de hoy:
La recomendación es que visites la siguiente página electrónica donde podrás encontrar información interesante sobre corrosión.
En las siguientes sesiones aprenderás:
Cómo identificar las reacciones de óxido-reducción en actividades experimentales.
Cómo asignar el número de oxidación de elementos metálicos representativos.
¡Buen trabajo!
Gracias por tu esfuerzo.
Para saber más:
Lecturas


Login to join the discussion