¿Compuestos iónicos o moleculares?
Valoración de la comunidad:
Última Actualización:
6 de Febrero de 2025 a las 17:12¿Compuestos iónicos o moleculares?
Aprendizaje esperado: identifica que las propiedades de los materiales se explican a través de su estructura (atómica, molecular, iónica).
Énfasis: diferenciar entre compuestos iónicos y moleculares a partir de sus propiedades.
¿Qué vamos a aprender?
Bill Nye, que es un divulgador de la ciencia, te hace reflexionar acerca de esta frase: “La ciencia es la clave de nuestro futuro y si tú no crees en la ciencia, entonces nos estás reteniendo a todos hacia atrás”.
Te das cuenta que juntos se puede construir un futuro que tenga un sustento tanto científico como ético y, con ello, lograr una convivencia armónica en el entorno social y natural.
En esta sesión diferenciarás entre compuestos iónicos y moleculares a partir de sus propiedades.
Todo lo que aprenderás lo harás a través de la relación de la química con la biología, o sea, la bioquímica.
¿Qué hacemos?
La química es tan cercana a ti que ni te percatas de cómo sería la vida sin ella. Desde las culturas prehispánicas eran bien conocidas las propiedades de las sustancias, así como los procesos químicos que satisfacían diferentes necesidades humanas.
¿Sabías que, sin química no hay cocina? Una reacción de óxido de calcio es la clave de tu dieta.
En México, uno de los alimentos indispensables es la tortilla, que se elabora con maíz. Para la obtención de masa de maíz, previamente es necesario llevar a cabo una reacción química fundamental: la nixtamalización.
Este tratamiento consiste en la cocción en agua de los granos de maíz con óxido de calcio o cal de piedra.
Es el mismo compuesto que se utiliza para la construcción. El óxido de calcio se combina con las paredes celulares del maíz, formadas de celulosa, polímero natural que los humanos no digerimos.
En esta reacción se ablandan las paredes celulares, formando una especie de gelatina, de manera que los granos son mucho más suaves. Además, se incorpora calcio, por lo que, al ingerir tortillas o alimentos derivados del maíz, es una fuente de calcio que es necesario para el buen funcionamiento del organismo, en particular, del sistema óseo.
Gracias a la nixtamalización, puedes disfrutar de las sabrosas tortillas y todos esos platillos en los que se utiliza el maíz.
La ciencia la practicaban las culturas prehispánicas y se sigue aplicando en la actualidad, y en algo tan rico como lo es la gastronomía.
Si tienes alguna duda o inquietud, escríbela en el cuaderno, para que con ayuda de tus profesores y a distancia, las puedas resolver.
Tu cuerpo está constituido por una infinidad de átomos, iones y moléculas, los cuales están en constante interacción, tú mismo eres la evidencia de esas interacciones. Toda la materia, incluyendo a los seres vivos, está compuesta por distintos átomos
Conocerás y comprenderás desde la química cómo es que funciona en tu cuerpo, y también aprenderás por qué es necesario cuidar tu cuerpo.
Los seres vivos están caracterizados, entre otras cosas, por tener una organización celular; es decir, los seres vivos están formados de una o más células, al interior hay iones y moléculas que se organizan en estructuras celulares.
Otra manera de decirlo es que las células son como los ladrillos que construyen los tejidos; éstos, a su vez, a los órganos y sistemas que conforman a los individuos.
Pues bien, las moléculas son como estas partículas o polvo que constituyen a este ladrillo. Las moléculas están constituidas aproximadamente en 98 por ciento de elementos como C, H, O, N, P y S, mientras que el otro 2% corresponde a elementos como el hierro, calcio, sodio, cobre, magnesio, yodo y cloro.
Las distintas combinaciones en que estos elementos se pueden unir dan lugar a la formación de millones de moléculas con propiedades específicas. Las que están compuestas de carbono se denominan compuestos orgánicos, uno de los más importantes es la glucosa.
Esta molécula, junto con otras, participa en reacciones, las cuales producen una molécula llamada ATP, que contiene una gran cantidad de energía. ATP es la abreviatura que se usa para referirnos al adenosín trifosfato.
Observa las fórmulas tanto de la glucosa como la del ATP, y anota cuáles son los elementos que los componen.
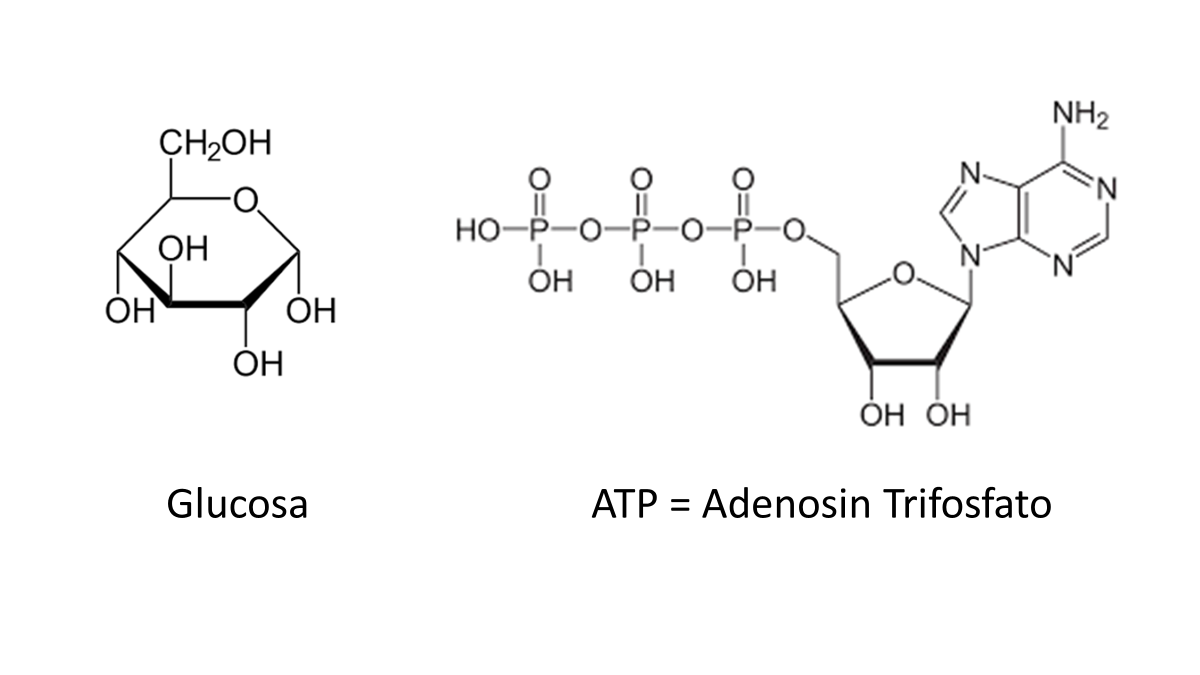
Continúa con la composición de los seres vivos. Además de la glucosa que pertenece a los carbohidratos, existen otras moléculas, como las proteínas, los lípidos y ácidos nucleicos, éstos representan 30%, el agua constituye 70% del cuerpo humano, pero también encuentras algunos iones tales como el sodio, el hierro, calcio, potasio, etc., en proporciones muy pequeñas, pero con funciones muy importantes.
Recuerda que en sesiones anteriores has establecido que toda la materia está constituida por átomos y que reaccionan para formar una molécula, y que tienden a adquirir una configuración más estable como la de los gases nobles.
Los elementos tienden a ser estables a completar ocho electrones de valencia, es decir, en su órbita o nivel de energía más alejado del núcleo, con base en la regla de octeto.
Los átomos se mantienen unidos y forman moléculas por medio de enlaces químicos. En el cuerpo ocurren reacciones químicas o, en este caso, llamadas reacciones metabólicas, donde se producen o se degradan continuamente moléculas; es decir, se forman y se rompen uniones químicas.
En estas uniones algunos átomos tienden a ganar o perder electrones con gran facilidad debido a su configuración electrónica, formando átomos con carga eléctrica, que se denominan iones. Aquellos átomos que ganan con facilidad electrones se dice que son electronegativos y formarán iones con carga negativa, llamados aniones. Si el átomo pierde electrones, predominarán las cargas positivas del núcleo y, por lo tanto, se forman iones con carga positiva, nombrados cationes.
En los compuestos iónicos, los átomos se mantienen unidos debido a las fuerzas de atracción que surgen por tener cargas opuestas: catión - anión.
Pero, ¿qué propiedades tienen los compuestos iónicos?
Elabora en tu libreta un cuadro comparativo, a partir de las lluvias de ideas, conceptos que estás aprendiendo en esta sesión. Añade aquellos conceptos a tu glosario, que identifiques en esta sesión.
Los compuestos iónicos tienen las siguientes propiedades: Temperatura de ebullición alta, al igual que la temperatura de fusión, generalmente son solubles en agua, en forma de cristales, no conducen la corriente eléctrica, pero en disolución acuosa sí la conducen. Pero, ¿cómo es esto posible?
Observa como ejemplo el cloruro de sodio. Los átomos de cloro son mucho más electronegativos, por lo que atraen con fuerza al electrón de valencia de los átomos de sodio.
Entonces los átomos de cloro atraen el electrón de valencia, es decir, el electrón de la órbita o nivel de energía más alejado del núcleo. Y el cloro se transforma en el anión cloruro, y el sodio, en catión. La atracción eléctrica entre ellos hace que los iones permanezcan unidos.
El ion sodio forma parte de las secreciones digestivas, participa en la absorción de nutrimentos. Otro ion, el potasio, es esencial para el bombeo de la sangre del corazón. La pérdida del potasio causa hipotonía, hiporreflexia, alteración del impulso nervioso y puede llevar a la muerte por paro cardiaco.
Es decir, hipotonía significa “falta de tono muscular” y la “hiporreflexia” es la disminución de la respuesta reflejo. El potasio se encuentra dentro de la célula, es decir, es un ion intracelular, a diferencia del sodio, que es un ion extracelular.
Otro ion importante es el ion calcio+2, que se localiza en el tejido óseo, junto al fósforo forma un complejo llamado hidroxipatita. En otros tejidos, como en los músculos, participa en su contracción muscular y en la coagulación sanguínea.
¿Recuerdas en qué proceso químico prehispánico se puede incorporar calcio a nuestra dieta? En efecto, en la nixtamalización.
Además, con el ion calcio, junto con el ion Mg+2,se localiza en los tejidos blandos e interviene en más de 300 reacciones enzimáticas. En los vegetales forma parte de la molécula de la clorofila, y también interviene en la transmisión del impulso nervioso. Si careces de este ion, presentarías irritación nerviosa y convulsiones.
Analiza los iones Fe+2 y Fe+3, que en la sangre se encuentran en los eritrocitos, células encargadas de transportar el oxígeno a todas las células. No se encuentran libres, se encuentran unidos a una proteína llamada hemoglobina.
Sin el hierro, te sientes fatigado y tienes bajo rendimiento físico, ya que el transporte del oxígeno a las células del cuerpo se ve afectado y este elemento es esencial para los seres vivos.
¿Cuál es el ion que participa junto con la hemoglobina en el transporte del oxígeno? El ion ferroso es de carga positiva 2, formando el grupo que se conoce como hemo.
Hay otros iones que son fundamentales, como el cinc, el cobre, el yodo, el grupo fosfato (PO4)-3, el Cl- cloruro, el sulfuro, el Mg+2 y el fluoruro.
Busca en una fuente confiable y elabora un cuadro donde coloques, cuál es la importancia de los iones en el cuerpo humano que se acaban de mencionar.

Algunos átomos tienden a compartir electrones de valencia con otros átomos. Entonces se habla de compuestos moleculares. Cuando la diferencia de electronegatividad no existe o es muy baja, los átomos de elementos químicos que se unen comparten electrones de valencia.
El gas hidrógeno está compuesto por moléculas de hidrógeno y no por átomos de hidrógeno separados. Cuando un átomo de hidrógeno se une a otro átomo de hidrógeno, ambos tienen la misma capacidad de atraer los electrones.
Por lo tanto, el par de electrones compartido se ubicará a igual distancia de los núcleos. Los átomos de hidrógeno comparten sus electrones para tener la configuración electrónica de un gas noble, en este caso, el helio.
Los átomos compartidos pertenecen a ambos. Observa el siguiente ejemplo. Esto ocurre si los elementos tienen la misma o similar electronegatividad, hay casos donde existe una diferencia de electronegatividad.
Estos enlaces se llaman covalentes polares, la distribución de los electrones es asimétrica, se producen zonas donde predominan las cargas parcialmente negativas de los electrones. Cerca de los átomos de elementos más electronegativos.
Hay zonas donde predominan las cargas parcialmente positivas, que se deben a los núcleos. Esto sucede en los átomos de los elementos menos electronegativos, ya que sus electrones de valencia están lejos.
Este tipo de unión es la que encuentras en la mayor parte de las moléculas biológicas. El carbono se une a otros elementos como el hidrógeno, oxígeno, nitrógeno, fosforo y azufre por medio de enlaces covalentes, así como se une a otros átomos de carbono, formando largas cadenas. Por ejemplo, la glucosa, que es un azúcar de la cual puedes adquirir energía. Otro ejemplo son las proteínas, como el colágeno, los lípidos o grasas, como los ácidos grasos.
Otra molécula que es sumamente importante es el agua. Las células de las cuales estamos constituidos contienen entre 70 a 90% de agua, y todas las reacciones que ocurren en el citoplasma son en un medio acuoso.
Recuerda que la célula es como una fábrica donde se realizan muchos procesos, y en una fábrica se tienen varios departamentos o áreas de producción. El citoplasma es uno de ellos, su función es la de albergar a otros departamentos o áreas, pero no se llaman así en la célula, se llaman organelos celulares. Está compuesto por agua en su mayoría, sales y otras moléculas.
El agua es un disolvente biológico ideal. La molécula de agua consta de dos átomos de hidrógeno unidos a uno de oxígeno mediante un enlace covalente. Debido a la diferencia de electronegatividad entre ellos, se produce una distribución asimétrica de cargas, por lo que se forma una molécula dipolar.
El oxígeno, que es más electronegativo, atrae con más fuerza al par de electrones que comparte con cada hidrógeno, generando así una carga parcial negativa en este átomo y cargas parciales positivas en los átomos de hidrógeno.
¿Qué propiedades tiene el agua? Descríbelas en tu cuaderno.
El agua tiene un estado de agregación líquido si oscila entre los cero y cien grados Celsius. El hielo flota en la misma agua, pero líquida, es decir, el agua en estado sólido tiene menor densidad que en estado líquido. El agua actúa como disolvente para moléculas polares.
La alta polaridad del agua favorece también a la célula, porque fuerza a las sustancias no polares a agregarse o mantenerse juntas, contribuyendo así a la formación de las membranas, que están constituidas principalmente por sustancias no polares.
Las membranas son otro organelo celular y su principal función es ser una barrera selectiva de sustancias y delimitar a la célula.
Las membranas están formadas por lípidos, los cuales cumplen una función de ser la barrera selectiva para la célula. Es decir, selecciona qué sustancias ingresan a la célula y cuáles salen de la misma.
El tipo de enlace entre los átomos o iones de una sustancia se relaciona con sus propiedades físicas y químicas.
Por ejemplo, la mayoría de los compuestos iónicos, como el cloruro de sodio, son sustancias sólidas con altas temperaturas de fusión y ebullición debido a que la fuerza de atracción entre iones positivos y negativos es muy grande, y es necesario invertir mucha energía para separarlos.
La gran mayoría de los compuestos iónicos son solubles en agua. Los compuestos iónicos en disolución pueden conducir la corriente eléctrica por la presencia de cationes y aniones. Sin embargo, en estado sólido no conducen la corriente eléctrica.
Para comprender mejor este tema, observa el siguiente video del minuto 3:44 a 6:41
- ¿Qué es el enlace químico?
https://www.youtube.com/watch?v=0fyZ8H3JKq4
Ejemplos de compuestos iónicos son las sales, es decir, compuestos formados por un metal y un no metal. Como, por ejemplo, el sulfato de cobre que es un fungicida, que elimina hongos y algas en piscinas.
Los compuestos moleculares pueden ser sólidos, líquidos o gaseosos a temperatura ambiente. Como ejemplos:
La glucosa (C6H1206) es un sólido.
El agua es un líquido.
Y el dióxido de carbono (CO2) es un gas.
Los compuestos moleculares como el dióxido de carbono o la glucosa comparten un par de electrones.
Son sustancias blandas, con solubilidad variable y no conducen la corriente eléctrica. Otro ejemplo es el azufre; tiene una temperatura de fusión baja, es sólido a temperatura ambiente.
Existen casos especiales, como el diamante, formado exclusivamente por carbono, que, aunque presenta enlaces covalentes, tiene una temperatura de fusión muy alto, de 3 550° Celsius.
Utilizando ciertos criterios, es sencillo clasificar una sustancia concreta en compuestos iónicos o moleculares. Por ejemplo, si una sustancia es gaseosa a temperatura ambiente, es seguro que se trata de una sustancia molecular. Si conduce la corriente eléctrica, casi pueden asegurar que se trata de un metal. Los metales son buenos conductores de la corriente eléctrica
¿Por qué las moléculas tienen una geometría característica? La molécula de CO2 es lineal y simétrica, mientras que la de H2O también es simétrica pero angular, con un ángulo de enlace de 104. 5° Esto es debido a la repulsión de las cargas; recuerden que cargas iguales se repelen o se alejan y las cargas diferentes se atraen.
Los compuestos iónicos forman estructuras regulares tridimensionales, llamadas estructuras gigantes, redes cristalinas o cristales. Cuantos más átomos o iones hay, más grande es el cristal. La ordenación de los átomos o iones a escala submicroscópica se reproduce a escala macroscópica, como puedes observar en el cristal del sulfato de cobre.
Sin embargo, en los compuestos moleculares hay un número finito de átomos unidos entre sí, dando lugar a la agrupación de 2 o más átomos llamadas moléculas. Sólo forman redes covalentes los elementos del grupo 14 carbono y silicio.
Son los únicos que forman cuatro enlaces: los elementos con tres enlaces no pueden formar redes, ya que tres puntos siempre determinan un plano.
En el caso del silicio, se forman los silicatos, que son el grupo de minerales de mayor abundancia. Además de formar estructuras gigantes, el carbono da lugar a cadenas carbonadas, en las que se une fundamentalmente a hidrógeno, dando lugar a hidrocarburos y al resto de compuestos del carbono, comúnmente conocidos como compuestos orgánicos y que son la base de la materia viva. Una última propiedad interesante es la solubilidad. La gran mayoría de los compuestos iónicos son solubles en agua.
Los iones, cuando están en disolución, “se rompen” las interacciones ión-ión, en consecuencia, hay interacciones entre los iones y las moléculas de agua.
Cuanto más débiles sean las interacciones entre iones, más fácilmente se disolverá el compuesto iónico en agua
Considerando la constitución del cuerpo y de la importancia del agua, pasa a:
Dato curioso. Distribución de agua en el cuerpo.
- Entre 80% y 90% de la sangre es agua.
- La piel contiene entre 70% y 75% de este líquido.
- El corazón, el hígado y los riñones, entre 70% y 80%.
- Los pulmones, alrededor de 85%.
- Los huesos contienen 22% de agua.
- Los músculos, entre 70% y 75%.
- El cerebro, en torno a 75% u 85%.
- El tejido graso presenta 10%.
- Los ojos están compuestos de agua en una proporción de 90-95%
El cuerpo humano es casi pura agua.
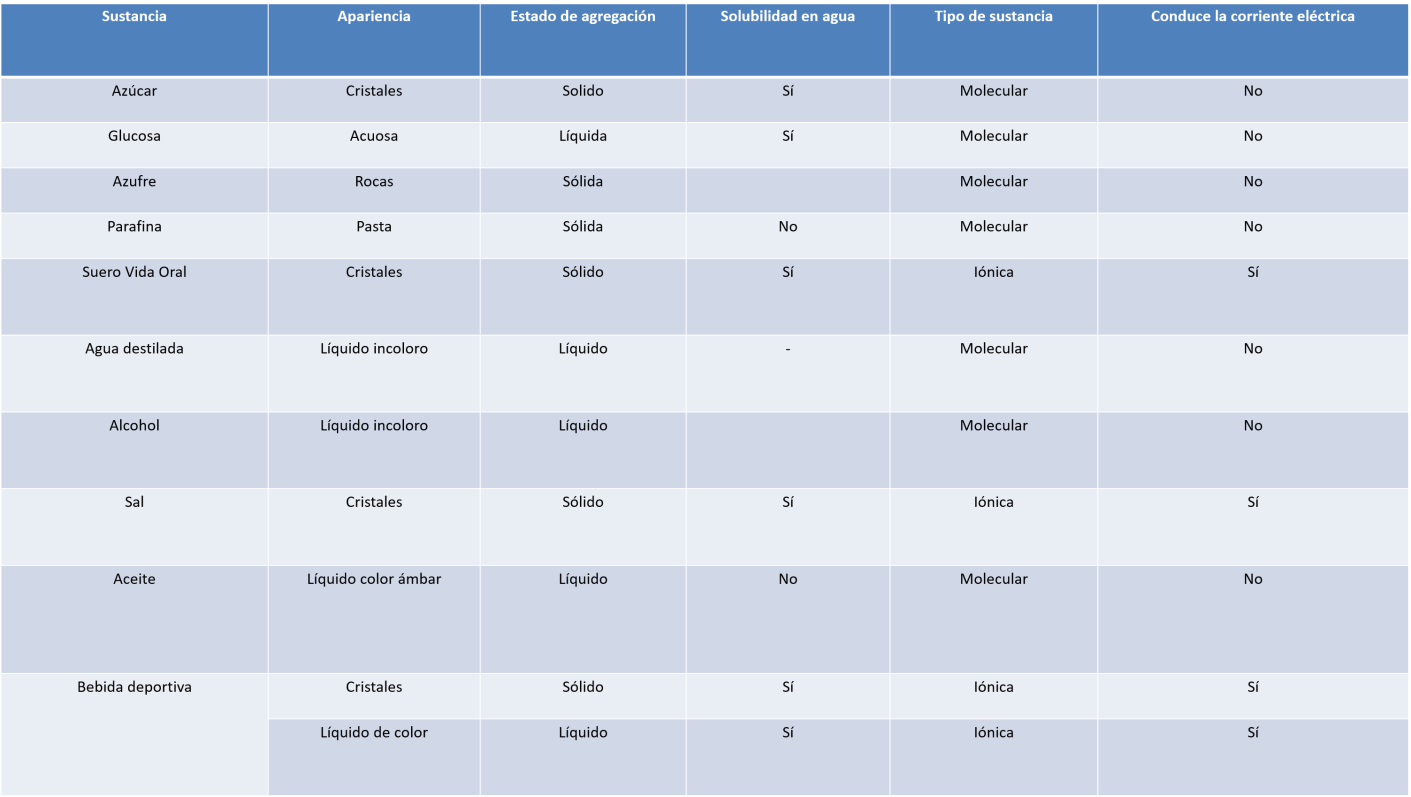
Los compuestos iónicos y moleculares tienen propiedades distintas. El propósito de esta actividad experimental es distinguir compuestos iónicos y moleculares con base en sus propiedades.
Los materiales que necesitarás son:
- Sal. Este es su nombre común, su nombre en la química es cloruro de sodio.
- Sulfato de cobre
- Azúcar
- Glucosa. Tanto el azúcar y la glucosa son carbohidratos.
- Azufre y/o parafina,
- Sobre de Vida Suero Oral; de no conseguirlo, elabora tu propio suero de vida oral de la siguiente forma: 2 cucharadas soperas de azúcar; media cucharadita de bicarbonato de sodio; media cucharada de sal, y cuando le agregues un litro de agua, puedes darle sabor con jugo de limón.
Otros materiales que vas a necesitar son: - Agua destilada o puede ser agua que previamente la pusieron hervir; alcohol;
- aceite;
- bebida deportiva. Puede ser en polvo o líquido.
- Vasos de precipitado, pero si no los consiguen, unos de plástico transparente les serán de mucha ayuda;
- una espátula o cuchara,
- y dispositivo para medir conductividad de corriente eléctrica.
Analizarás la apariencia, estado de agregación, solubilidad en agua, temperatura de fusión y la conductividad de corriente eléctrica de cada sustancia.
Anota tus observaciones en un tabulador como en el que se muestra a continuación.

Te sugerimos que coloques identificaciones en los vasos con algún marcador, etiqueta o cinta adherible. Observa cada sustancia que tienes, anota la apariencia y estado de agregación.
En una cucharilla de combustión colocarás el sulfato de cobre; en la otra, el azúcar. Observa cuál se hace líquida.
Esta parte la podrás hacer en tu casa, con la ayuda de un adulto, en corcholatas de metal y retirando el plástico que tienen, y sobre un comal. Coloca las sustancias, ponle una fuente de calor controlable. Observa qué ocurre y anótalo.
Recuerda siempre tener las medidas necesarias para prevenir un accidente. Toma una cantidad suficiente de cada una de las sustancias sólidas, en cada uno de los vasos de plástico agrega aproximadamente 10 ml de agua y agita.
A las sustancias liquidas, las colocas en un vaso, aproximadamente 10 ml, y agregas 10 ml de agua, agita y observa si son solubles en agua o no.
Finalmente, en los vasos que contienen los sólidos disueltos, introduces las puntas de este dispositivo, que es un circuito eléctrico, para comprobar si conducen la corriente eléctrica o no.
En el caso de las sustancias líquidas, las colocas en los vasos de plástico y compruebas su conductividad de corriente eléctrica. A partir de las propiedades de cada sustancia, infiere si se trata de una sustancia iónica o molecular.
Observa el siguiente cuadro donde, a manera de concreción, explica las propiedades de las sustancias iónicas o moleculares.

Que den calambres, o, mejor dicho, espasmos musculares, indica que hay un desequilibrio iónico entre los iones que intervienen en la contracción muscular, es decir, entre el sodio y el potasio.
Además de que, si no consumes suficiente cantidad de agua, no se pueden llevar a cabo las reacciones con los compuestos moleculares.
Recuerda que la glucosa, al presentar enlace covalente, da pie a la formación de nuevas moléculas que son las que te darán energía para que sigas ejercitándote; esta súper molécula que se llama ATP o adenosín trifosfato.
Observa como quedó resuelto el cuadro que se hizo en la experimentación y verifica tus respuestas.
Además, es importante que comentes con tus profesoras y profesores aquellas respuestas donde tengas duda o que quieras ampliar el conocimiento.
El reto de hoy:
La lectura abre la posibilidad de crear, reflexionar, imaginar; por ello, ¿qué leer?
Te recomendamos a Jhon Emsley, Moléculas en una exposición, lo podrás encontrar en la colección de los Libros del Rincón.
¡Buen trabajo!
Gracias por tu esfuerzo.
Para saber más:



Login to join the discussion