¿Cómo se llevan a cabo las reacciones redox?
Valoración de la comunidad:
Última Actualización:
6 de Febrero de 2025 a las 17:12Aprendizaje esperado: analiza los procesos de transferencia de electrones en algunas reacciones sencillas de óxido-reducción en la vida diaria y en la industria.
Énfasis: analizar los procesos de transferencia de electrones en algunas reacciones sencillas de óxido-reducción en la vida diaria y en la industria
¿Qué vamos a aprender?
Lee la siguiente frase del ganador del Premio Nobel de Química en 1987, Jean-Marie Lehn.
«La química es como el arte. Por ambos caminos obtienes cosas. Con la química puedes cambiar el orden de los átomos y crear realidades que no existían».
En esta sesión analizarás los procesos de transferencia de electrones en algunas reacciones sencillas de óxido-reducción en la vida diaria y en la industria.
Los materiales que necesitarás son tu cuaderno, tu libro de texto, lápiz, bolígrafo y colores.
NOTA para el docente. Revisa la Nueva Taxonomía de Marzano y Kendall del Manual Nueva Taxonomía, elaborado por la doctora Katherina Edith Gallardo Córdova y que estarás empleando.
Con esta taxonomía podrás combinar las dos dimensiones, niveles de procesamiento y dominios del conocimiento.
Puedes encontrarla en la siguiente dirección electrónica:
http://www.cca.org.mx/profesores/congreso_recursos/descargas/kathy_marzano.pdf
¿Qué hacemos?
¿Sabías que en el revelado de las fotografías se involucra la oxidación y la reducción?
La fotografía en blanco y negro es una forma de arte popular. Las imágenes que se captan y se imprimen en películas blanco y negro son el producto de una serie de reacciones óxido reducción o redox.
La primera reacción redox fija la imagen en la película de la cámara. La segunda, es una reacción para producir una imagen en negativo de la película expuesta. La tercera reacción redox crea la impresión positiva de la imagen en el negativo.
Una reacción óxido-reducción es cualquier reacción química en la cual se transfieren electrones de un átomo a otro.
La oxidación y la reducción siempre ocurren simultáneamente. En el proceso de oxidación un reactivo pierde electrones mientras que en el proceso de reducción se lleva a cabo el suministro de electrones en una especie química. Como podrás darte cuenta, en una reacción redox un reactivo pierde electrones que son captados por otro de los reactivos.
Reafirmando, la oxidación ocurre cuando un átomo cede electrones y la reducción se presenta cuando un átomo gana electrones. Sí, el que se oxida pierde.
Cuando un elemento químico se reduce al ganar electrones, a veces se vuelve negativo, y el elemento que se oxida, es decir, el que pierde electrones, a veces se vuelve positivo. Recuerda que los electrones tienen carga negativa.
Para comprender mejor lo anterior, realiza la siguiente actividad experimental.
¿Qué necesitas?
- Un vaso de precipitados de 250 ml.
- 100 ml de ácido clorhídrico.
- 20 g de granalla de zinc.
- Encendedor para estufa.
¿Cómo lo harás?
Coloca el ácido clorhídrico en el vaso de precipitados, posteriormente agregas con cuidado la granalla de zinc y se observa que en la reacción se produce un burbujeo, lo que indica la liberación de un gas.
Si acercaras un encendedor a la boca del vaso de precipitados se observaría que la flama se aviva.
Revisa la ecuación de la reacción. Cuando el ácido clorhídrico interactúa con el zinc, se produce una reacción química, donde el zinc reacciona con el cloro y desplaza al hidrógeno.
Observa que las burbujas que se liberan son gas hidrógeno, por lo que, al acercar el encendedor, el hidrógeno se quema, ya que es una sustancia flamable.
Esta es una reacción de óxido reducción. Para confirmarlo, observa qué elemento se oxida y qué elemento se reduce en la ecuación.
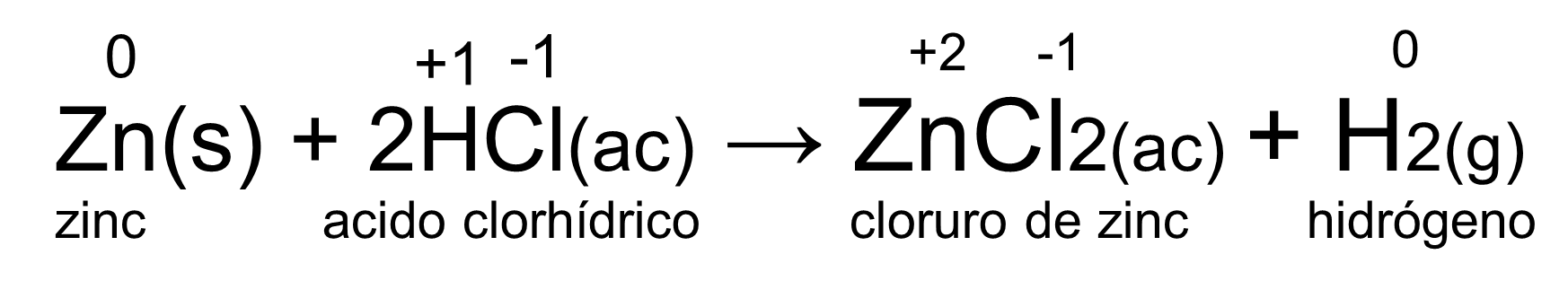
Puedes darte cuenta en la ecuación que los números de oxidación de cada elemento en los reactivos son los siguientes, el hidrógeno es más uno, el cloro es menos uno y el zinc es cero.
Después de reaccionar, es decir, observando los productos observas sus números de oxidación, el zinc pasó de cero a más dos, mientras que el cloro no cambia, ya que sigue siendo menos uno. Por otro lado, el hidrógeno cambió de más uno a cero.
Para identificar quién se oxida y quién se reduce observa la semirreacción del zinc y te apoyarás en la siguiente recta numérica. Se mencionó que el zinc pasó de cero a más dos. Observa en la recta numérica de óxido-reducción el desplazamiento del caballito de mar.
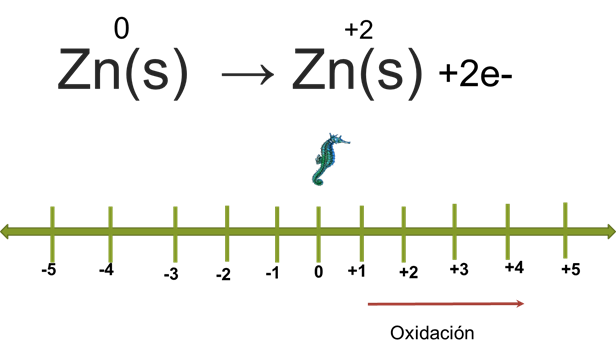
Lo colocas en el cero, que era inicialmente el número de oxidación del zinc. Al reaccionar observas en la ecuación que en los productos ya su número de oxidación es más dos. Desplazas entonces el caballito de mar de cero a más dos, a la derecha. Nota en la recta numérica que el zinc se oxidó perdiendo dos electrones, pero ¿a dónde se fueron?
Para contestar esta pregunta, observa la semirreacción del hidrógeno. Al inicio, su número de oxidación era de más uno y al final pasó a cero en la recta numérica, al desplazar el caballito de mar de uno a cero, puedes detectar que ganó un electrón, por lo que se reduce. Es muy importante que observes que el hidrógeno tiene un subíndice de dos, esto quiere decir que, cada hidrógeno ganó un electrón, por lo que ahora sabes que el hidrógeno gas ganó los dos electrones que perdió el zinc.
Entonces, ¿cómo es el proceso de la oxidación y la reducción en la fotografía?
Cuando el obturador de la cámara se abre, la luz que entra energiza los granos de bromuro de plata, haciendo que algunos de los iones de bromuro pierdan un electrón. Esto se representa con la siguiente ecuación, el bromuro de plata se descompone en bromo y plata. Nota el cambio que hubo en los números de oxidación de cada elemento.
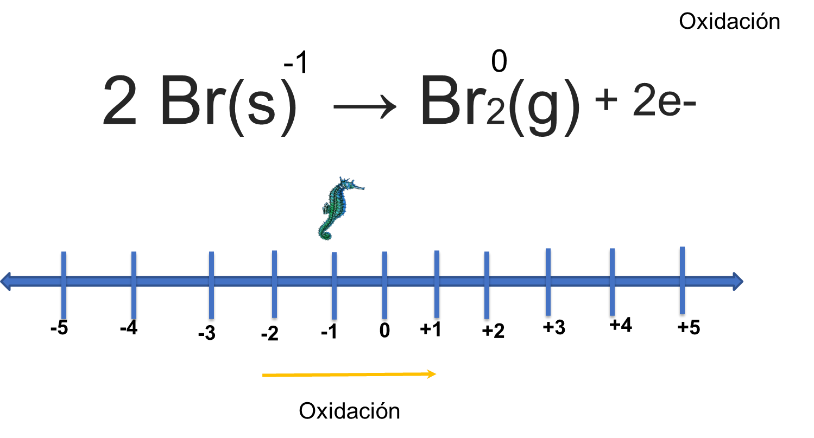
Observa la semirreacción para el bromuro. El bromuro pasó de menos uno a bromo molecular, por lo que se le asigna un número de oxidación de cero, que colocarás en la recta numérica con la ayuda del caballito de mar. ¿Te diste cuenta que se oxidó al pasar de menos uno a cero? Recuerda que cuando se pierden electrones, ocurre una oxidación y como son dos átomos de bromo, se pierden dos electrones; el que se oxida pierde.
Representa la semirreacción de la plata. En la ecuación observas que la plata tenía un número de oxidación de más uno en el lado de reactivos y pasó a cero en los productos. Este movimiento lo representas en la recta numérica con la ayuda del caballito de mar, al moverse de más uno a cero se observa que se reduce, por lo que gana un electrón. Observas que existen dos átomos de plata y cada uno gana un electrón, por lo que serán en total dos electrones los que se transfieren. Como en el ejemplo anterior, la oxidación del bromo produce simultáneamente la reducción de la plata.
¿Sabías que las reacciones óxido reducción ayudan en el lanzamiento de un transbordador espacial?
El transbordador espacial obtiene casi 72% de su fuerza ascensional de sus cohetes propulsores durante los primeros dos minutos del lanzamiento. Los tanques en forma de lápiz se encuentran adheridos a ambos lados del tanque de combustible de hidrógeno líquido y de oxígeno. Cada cohete propulsor contiene 495 mil kilogramos de una mezcla explosiva de perclorato de amonio y aluminio, donde el aluminio se oxida al perder electrones y el nitrógeno, al ganar electrones se reduce.
Al representar simbólicamente una reacción mediante una ecuación química, podrás identificar a los elementos químicos que llevan a cabo el intercambio de electrones identificando quién se oxida y quien se reduce, respectivamente.
¿Has considerado los colores del arcoíris? El efecto camaleón.
Lo harás con una actividad experimental.
¿Qué necesitas?
- Un matraz Erlenmeyer.
- Una plancha con agitación magnética.
- 3 g de azúcar.
- 3g de hidróxido de sodio.
- 3g de permanganato de potasio.
- Agua destilada.
Agregas 200 ml de agua destilada en el matraz Erlenmeyer y en esta se vierten los 3 g de azúcar y los 3 g de hidróxido de sodio. Se agita hasta disolver.
Se disuelven los 3 g en 50 ml de agua.
Lentamente agregas 3 ml de la disolución de permanganato de potasio y observas el resultado.

La reacción química camaleón muestra la reducción de permanganato de potasio violeta primero a manganato de potasio verde y finalmente a dióxido de manganeso de color marrón.

Observa las semirreacciones. El primer color púrpura corresponde a iones permanganato (MnO 4 – ). El manganeso tiene estado de oxidación +7. Los iones permanganato se reducen después a iones manganato. El estado de oxidación del manganeso cambia de +7 a +6, indicando la reducción al ganar un electrón y el color varía de púrpura a verde.

Los iones manganato (MnO 4 2– ), que tienen un número de oxidación +6, se reducen aún más hasta dióxido de manganeso (MnO 2 ), con estado de oxidación +4, lo que provoca el cambio de color de verde a amarillo-marrón.
Precisamente, los diferentes colores se deben a los distintos estados de oxidación del manganeso. En la semirreacción del azúcar, la cual contiene glucosa, existen grupos de alcoholes (OH), que en disoluciones alcalinas se oxidan por el permanganato produciendo una cetona; dicha oxidación genera la pérdida de electrones, los cuales son tomados por el manganeso para reducirse y generar los cambios de color.
Estos ejemplos ayudan para determinar en una reacción de óxido reducción qué elemento se oxida al perder electrones y cuál elemento se reduce al ganar electrones.
El magnesio es el catión extracelular más abundante en el cuerpo humano y el segundo intracelular más abundante después del potasio.
Este catión participa en más de 300 reacciones químicas a nivel celular. Es esencial para la transferencia, almacenamiento y utilización de la energía y también como regulador y catalizador. Tiene una función estructural en múltiples reacciones de óxido reducción en las que participa.
Se encuentra en forma de ion Mg 2+ y es necesaria su presencia para la síntesis de compuestos transportadores de energía como lo es el ATP.
En la síntesis y actividad de enzimas es un elemento constituyente de moléculas y como catión activa a enzimas.
Estabiliza a la membrana celular y regula a otros iones como Na + , K + y Cl - .
Su deficiencia se encuentra relacionada con alteraciones neurológicas, cardiovasculares, gastrointestinales y musculares. Por eso es fundamental para el buen funcionamiento de estos sistemas.
El magnesio se encuentra distribuido por el organismo de una persona, de 20 a 28gr; 90% del magnesio ingerido es absorbido en el intestino delgado para ser distribuido por todo nuestro cuerpo a nivel celular.
Por otro lado, estudios epidemiológicos han detectado que en países industrializados existe una deficiencia de este elemento en la alimentación hasta en 20% de la población.
Por lo tanto, no olvides consumirlo, está presente en cereales y harinas integrales, semillas de linaza, girasol, almendras, chocolate negro, garbanzo, lentejas, nueces, plátanos y avena.
Para que puedas confirmar los conocimientos que adquiriste durante esta sesión, completa la siguiente tabla. Puedes apoyarse en el ejemplo resuelto, donde el zinc se oxida y su número de oxidación cambia de cero a más dos, por lo que pierde dos electrones.
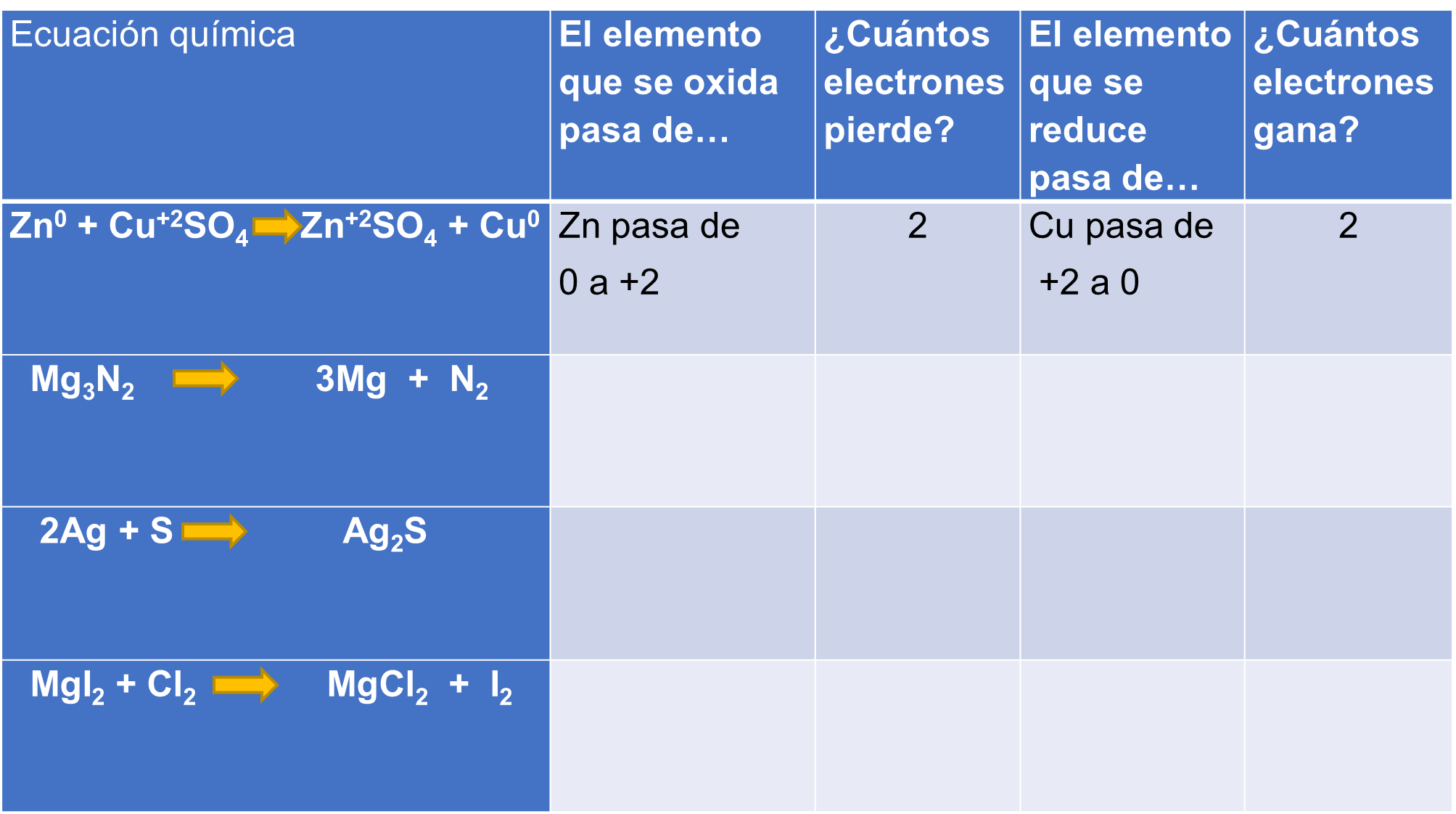
El cobre se reduce y cambia su número de oxidación de más dos a cero, por lo que gana dos electrones. No olvides apoyarte en tu tabla periódica para que puedas obtener los números de oxidación de los elementos que forman la ecuación. Recuerda que un elemento tiene un número de oxidación cero cuando está sin combinarse.
Ahora observa una cápsula del doctor José Luis Córdova Frunz, quien presentará ejemplos de reacciones de óxido-reducción.
- SEC_3_QUIMICA_JL_CORDOVA
El reto de hoy:
Para seguir aprendiendo sobre las reacciones de óxido reducción, se te recomienda consultar el libro “Química, Materia y Cambio”, de Laurel Dingrando. Ahí podrás encontrar más ejemplos de ecuaciones, números de oxidación y más aplicaciones que tienen las reacciones de oxidación y reducción en la vida diaria, así como en la industria.
¡Buen trabajo!
Gracias por tu esfuerzo.



Login to join the discussion