¿Cómo diferenciar propiedades extensivas e intensivas?
Valoración de la comunidad:
Última Actualización:
6 de Febrero de 2025 a las 17:12¿Cómo diferenciar propiedades extensivas e intensivas?
Aprendizaje esperado: identifica las propiedades extensivas (masa y volumen) e intensivas (temperatura de fusión y de ebullición, viscosidad, densidad, solubilidad) de algunos materiales.
Énfasis: diferenciar propiedades extensivas (masa y volumen) e intensivas (temperatura de fusión y de ebullición, viscosidad, densidad, solubilidad) de algunos materiales a partir de actividades experimentales.
¿Qué vamos a aprender?
Lee la siguiente frase del biólogo, médico y fisiólogo francés Claude Bernard, fundador de la medicina experimental.
“La observación en la ciencia es un acto pasivo; la experimentación algo activo.”
Durante el desarrollo de la sesión diferenciarás entre las propiedades extensivas (masa y volumen) e intensivas (temperatura de fusión y de ebullición, viscosidad, densidad, solubilidad) de algunos materiales a partir de actividades experimentales.
Recuerda que “la experimentación es algo activo”.
NOTA para el docente. Se te recomienda una herramienta digital llamada Google Slide. Es una plataforma donde puedes descargar plantillas gratuitas con las que puedes crear, editar y publicar –en diferentes plataformas digitales– presentaciones atractivas e interesantes.
Cada modelo incluye una colección de gráficos, mapas e iconos que puedes usar y personalizar.
Puedes acceder a través de la siguiente dirección electrónica y elegir las que más te agraden.
Los materiales que utilizarás en esta sesión es tu libro de texto de Ciencias. Química, tu cuaderno de notas, bolígrafos y colores.
También registra en tu Quimiglosario los datos que consideres más relevantes e incluye los conceptos necesarios para la comprensión del tema.
Resolverás las actividades que se te proponen y pondrás en práctica habilidades como la observación y la comparación, que has logrado desarrollar y fortalecer con ayuda de tus profesoras y profesores.
¿Qué hacemos?
Imagina 3 bolsas con diferentes cereales y responde las siguientes preguntas.
- ¿Cuál cereal tiene mayor cantidad?, ¿cómo puedes saberlo?
- ¿Es posible verter el contenido de cada bolsa en recipientes iguales? ¿Por qué?
Para determinar la cantidad de cereal contenido en cada bolsa es necesario utilizar una balanza o una báscula; ésta es el instrumento de medición empleado para medir la masa de un cuerpo.
Se identifican las cantidades con ayuda de una báscula de cocina. Toma nota de los resultados obtenidos.
Los cereales son y pesan:
Amaranto: 500 g
Avena: 500 g
Arroz: 500 g
Todos tienen la misma magnitud de masa.
Y si se intenta guardar en recipientes, no hay espacio suficiente para los cereales en los recipientes.
Pero ¿por qué pasa esto?
Las tres bolsas de cereal tienen la misma cantidad de masa, es decir, 500 g.
La masa es la medida de la cantidad de materia que hay en un objeto. Un objeto que tiene mucha masa está formado por una gran cantidad de materia.
En el Sistema Internacional de Unidades (SI) el kilogramo (kg) es la unidad de medida de la masa.
Si tienen la misma masa, es decir, 500 g, ¿por qué no fue posible que cada uno cupiera en los recipientes?
A simple vista se puede deducir que la bolsa que contiene el amaranto ocupa más espacio que la del arroz porque tienen diferente volumen.
El volumen es la medida del espacio que ocupa un objeto.
La unidad de medida del volumen en el Sistema Internacional de Unidades es el metro cúbico (m3).
Todos los objetos, sustancias y materiales del universo presentan al menos dos propiedades extensivas comunes, la masa y el volumen.
¿Sabías que? El Centro Nacional de Metrología es el laboratorio nacional en materia de medidas en México.
Se encarga de establecer y mantener los patrones de medida del Sistema Internacional de Unidades utilizados en el país, así como la hora oficial.
Sus aplicaciones desempeñan un papel central en el descubrimiento científico, la innovación, la fabricación industrial y el comercio internacional.
Fuente: https://www.gob.mx/cenam
A cualquier objeto que ocupe espacio, es decir, volumen y tiene masa, se le conoce como materia, y tiene unidades de medida determinadas por el Sistema Internacional de Unidades.
La masa y el volumen son propiedades extensivas, porque a mayor cantidad de materia, mayor masa o volumen. Esto significa que las propiedades extensivas cambian conforme cambia la cantidad de materia.
Por lo tanto, una propiedad extensiva es aquella que depende de la cantidad de materia que se va a estudiar.
La densidad, la viscosidad, la solubilidad, la temperatura de fusión y la temperatura de ebullición son ejemplos de propiedades intensivas de la materia, ya que éstas no dependen de la cantidad de materia.
En esta actividad experimental se formará un arcoíris líquido. Se deben formar franjas de colores con diferentes líquidos. Pero ¿cómo lograrás que los líquidos no se mezclen?
Utilizarás materiales que puedes encontrar en casa. Recuerda que cuando realices una actividad experimental, debes estar acompañado de un adulto.
¿Qué necesitas?
- Aceite
- Agua
- Alcohol etílico
- Miel
- 2 vasos largos y transparentes (si son de vidrio, ten mucho cuidado con su manejo)
- Recipientes graduados (pueden ser los dosificadores que vienen con los jarabes)
- Colorante vegetal (opcional)
¿Cómo lo harás?
- Mide 10 ml de cada tipo de líquido con ayuda de tus recipientes graduados. Si lo prefieres, puedes agregar color al agua y al alcohol para hacer más vistoso el resultado.
- Después, para formar el arcoíris, colocarás los líquidos en un mismo recipiente.
¿En qué orden debes agregarlos para evitar que se mezclen?
¿Cuál de las propiedades intensivas de la materia es importante para ello?
Plantea tus predicciones respecto al orden de los líquidos. Piensa ¿qué líquido verterás primero?
Comienza agregando la miel al recipiente, vierte lentamente.
Continúa con el agua, enseguida el aceite, y finalmente el alcohol. Está bien si los líquidos se mezclan un poco mientras los están agregando, las capas serán siempre visibles debido a sus densidades.
Ya tienes tu arcoíris líquido. Los líquidos están acomodados según su densidad. Recuerda que un líquido menos denso flotará encima de otro más denso.
La primera sustancia tendrá una masa mayor por volumen, lo que la vuelve más densa que la segunda.
Cabe mencionar que la densidad es una propiedad que permite identificar los materiales.
Como resultado se obtiene una serie de bandas o capas en el vaso. Cada líquido forma una capa porque es menos denso que el líquido de abajo y más denso que el de arriba.
La densidad es una propiedad específica de cada sustancia y se define como la cantidad de masa en un volumen determinado. En el Sistema Internacional de Unidades, la densidad se expresa en kilogramo sobre metro cúbico (kg/m3), que es equivalente al gramo sobre centímetro cúbico (g/cm3). Un líquido menos denso flotará por encima de otro más denso.
La densidad es una propiedad que no depende de la cantidad de materia, sino del tipo de sustancia.
Para comprobarlo, se triplica la cantidad de líquidos utilizados, es decir, 30 ml de cada uno y repites el mismo procedimiento.
El acomodo de los líquidos sigue siendo el mismo, porque su densidad se mantiene constante, sin importar la cantidad.
En la tabla siguiente puedes observar los valores de densidad de las sustancias utilizadas. Notarás que su valor es constante en condiciones normales de presión y temperatura.

Ahora continua con una carrera de líquidos.
¿Qué necesitas?
- Charola
- Miel
- Aceite
- Agua
- Salsa de tomate
- Cucharas
¿Qué harás?
- Protege tu mesa con algunas capas de papel para realizar la actividad experimental.
- Acomoda la charola para formar una pendiente.
- Escoge dos líquidos.
- Toma una cuchara y la llenas hasta la mitad con el líquido elegido.
- Cuando las cuatro cucharas estén listas, las vaciarás sobre la charola inclinada.
La ganadora o ganador será quien cuyo líquido llegue primero al final de la pendiente.
Haz una predicción sobre las siguientes preguntas:
¿Cuál será el líquido más rápido?
¿Cuál será el más lento?
¿A qué se debe que uno sea más rápido que otro?
Cuando se vierten los líquidos, existen algunos que son más viscosos que otros, por lo que es más complicado que se desplacen.
Con este experimento se demuestra que la viscosidad se manifiesta en líquidos en movimiento. Puedes definirla como la medida de la resistencia al movimiento que presenta un fluido y puede variar con la temperatura.
En el SI, la unidad física de viscosidad dinámica es el pascal segundo, que corresponde exactamente a un Newton por segundo (1 N s/m²) o (1 kg/(m/s). La unidad CGS para la viscosidad dinámica es el poise, que equivale 1 dina segundo/cm2 o 1 g/(cm s).
Es importante no confundir los conceptos de viscosidad y densidad en los líquidos. La densidad es la relación entre la masa y el volumen de un líquido, la viscosidad indica una propiedad, la que tienen los líquidos al fluir; aunque aumentaras la cantidad el resultado sería el mismo, ya que la viscosidad no depende de la cantidad de materia.
Piensa en la siguiente pregunta: ¿qué ocurre cuando se añaden diez cucharadas de azúcar en un vaso con agua?
Realiza la actividad experimental para observar lo que ocurre:- En un vaso agrega 100 ml de agua e irás agregando azúcar por cucharadas, para observar si es posible disolver completamente.
Como puedes observar, llega el punto en el que no es posible continuar disolviendo el azúcar, lo que ocasiona que ésta se deposite en el fondo del vaso.
Repite el mismo procedimiento, ahora con 100 ml de agua caliente. Vierte nuevamente, cucharada a cucharada.
¿Qué observaste?
Aunque utilizas la misma cantidad de agua, la solubilidad varía con la temperatura. En la mayoría de las sustancias, un incremento de la temperatura produce un aumento de la solubilidad.
Por esta razón, el azúcar se disuelve mejor en el café caliente y la leche debe estar en ebullición para preparar chocolate. Cuando se prepara agua de limón, es mejor disolver primero el azúcar y luego agregar los hielos, de lo contrario, el azúcar no se disolverá totalmente y la bebida no tendrá la dulzura deseada. En el agua caliente la disolución es más fácil, ya que aumenta la cantidad de azúcar que se puede disolver, propiedad conocida como solubilidad.
La solubilidad es la capacidad de una sustancia para disolverse en otra. Indica la máxima cantidad de dicha sustancia que se puede disolver en una cantidad de disolvente dada a una temperatura concreta.
Es importante recordar que una disolución consta de dos componentes:
- Disolvente. Por lo general se encuentra en mayor proporción y es el medio en el que se disuelve un soluto.
- Soluto. Por lo general, se encuentra en menor proporción y es el que se disuelve.
- En la actividad experimental el disolvente es el agua y el soluto es el azúcar.
Una disolución está saturada cuando, a una determinada temperatura, contiene la máxima cantidad posible de soluto; a éste se le conoce como punto de saturación.
Se puede llegar a este punto cuando se agrega paulatinamente una sustancia o soluto en un disolvente. Llegará un momento en que la sustancia no podrá disolverse, esto significa que ha alcanzado el punto de saturación y cualquier cantidad adicional de sustancia que se agregue al disolvente se precipitará al fondo del recipiente.
Una disolución sobresaturada es aquella que contiene más soluto del que puede existir en equilibrio a una temperatura y presión dadas. Si se calienta una disolución saturada, se le puede agregar más soluto; si esta disolución es enfriada lentamente y no se le perturba, puede retener un exceso de soluto pasando a ser una disolución sobresaturada.
Sin embargo, una disolución sobresaturada es un sistema inestable; con cualquier perturbación el soluto en exceso se precipita y la disolución queda saturada.
Ejemplos de disoluciones sobresaturadas son la miel de abeja y los almíbares.
La solubilidad de las sustancias en uno u otro disolvente varía; de hecho, algunas son muy poco solubles o insolubles.
La siguiente tabla muestra que la sal de cocina y el azúcar son muy solubles en agua, mientras que el bicarbonato de sodio se disuelve con dificultad.
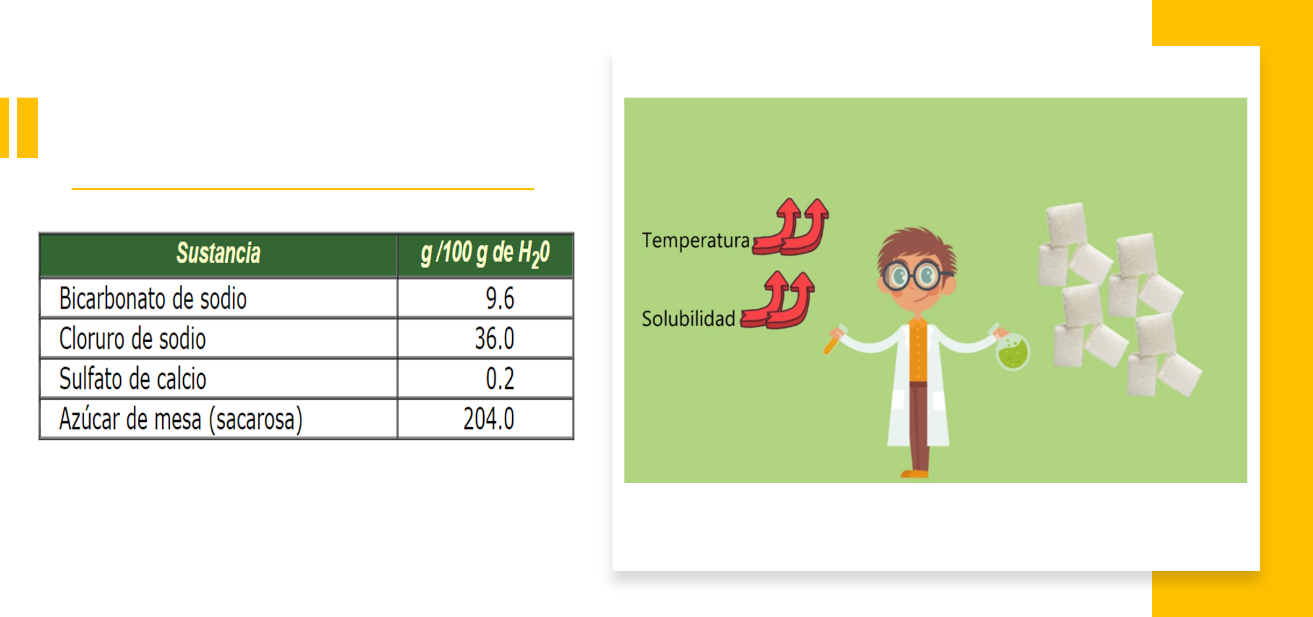
Aún falta por conocer dos propiedades interesantes que posee la materia.
En tu curso de Ciencias II, Bloque III, aprendiste que los estados de agregación de las sustancias dependen de la temperatura y la presión a las que están sometidas.
La temperatura se mide con un termómetro que deben colocar dentro de la sustancia. Si la sustancia es agua en estado sólido, es decir, hielos, notarás cómo desciende la temperatura hasta llegar a 0 °C. Si observas la temperatura por un tiempo, notarás que se mantiene constante, como se muestra en la gráfica.
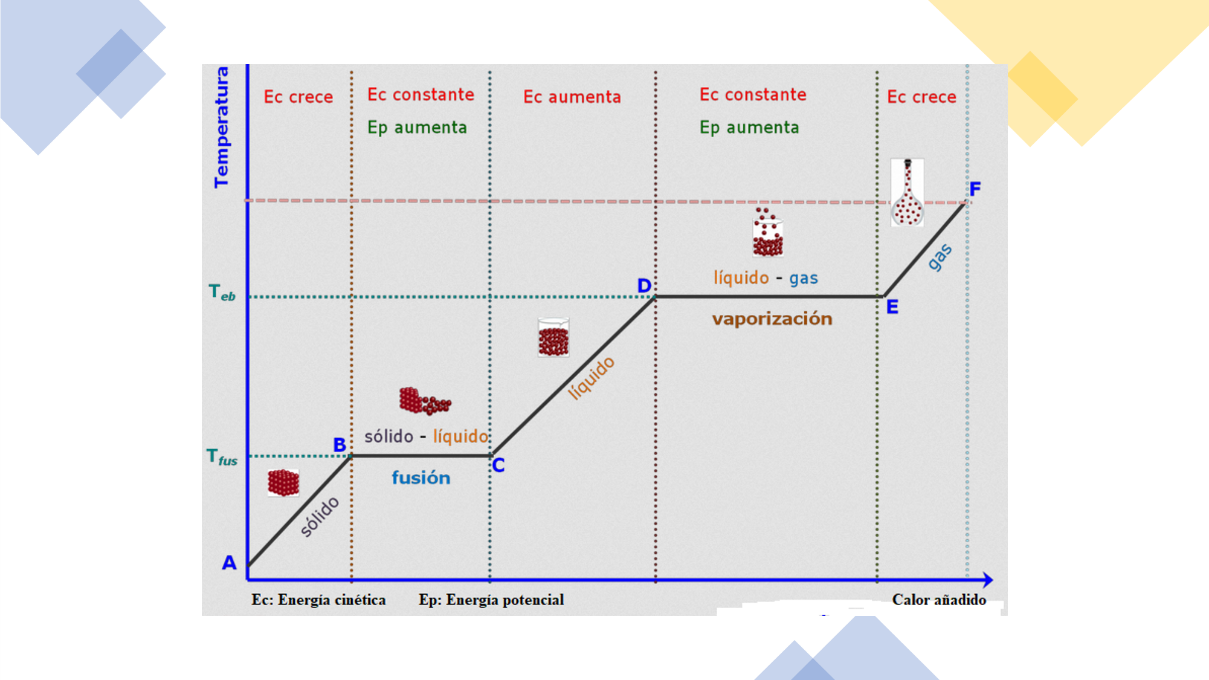
Cada sustancia tiene una temperatura de fusión determinada a una presión definida; por ello puedes utilizar esta propiedad para distinguir entre sustancias de aspecto parecido.
Observa el siguiente video del minuto 10:25 a 11:54.
- Transiciones de fase
Observa que, cuando pones al fuego un recipiente con agua, éste comenzará a subir la temperatura –lo que puedes confirmar con un termómetro– hasta que, una vez más, se mantiene constante por un tiempo. En ese momento deberás tomar nota porque esa es la temperatura de ebullición del agua.
El agua no es el único líquido que tiene temperatura de fusión y de ebullición. Esos parámetros son específicos para las sustancias, por eso, la temperatura de fusión y de ebullición ayudan a identificar a una sustancia como tal. Por ejemplo:
- La temperatura de fusión del agua es de 0 grados Celsius y su temperatura de ebullición es de 100 grados Celsius, ambas temperaturas a nivel del mar donde la presión es de 1 atm.
- En la Ciudad de México, el agua hierve a 94 grados Celsius, ya que la presión atmosférica es de 0.77 atm.
Todas las propiedades que has analizado a través de la experimentación corresponden a las propiedades intensivas de la materia que, como pudiste notar, no dependen de la cantidad de materia.
En el sector alimentario –especialmente en las industrias productoras de lácteos, salsas, aceites comestibles e incluso en la industria panadera– el concepto de viscosidad es muy importante, ya que ésta afecta la calidad de los productos que son comercializados.
¿Por qué les es importante medir la viscosidad?
Sirve a las industrias en el diseño de su infraestructura y durante la implementación de redes de manejo de alimentos dentro de la planta de producción, como es el caso de sistemas de bombas y tuberías, por donde fluirán los líquidos.
En el sector panadero la viscosidad de la harina usada en la producción es de vital importancia, porque ayuda a identificar las propiedades del producto final.
A temperaturas superiores a los 60 ºC, bacterias como la salmonella y otros microorganismos son destruidos. Afortunadamente, en todo el territorio nacional el agua hierve a una temperatura superior a los 60 ºC. Por ejemplo, en lo más alto del Pico de Orizaba, hierve a los 79 ºC, con lo que dichos microorganismos se destruyen al hervir los alimentos contaminados.
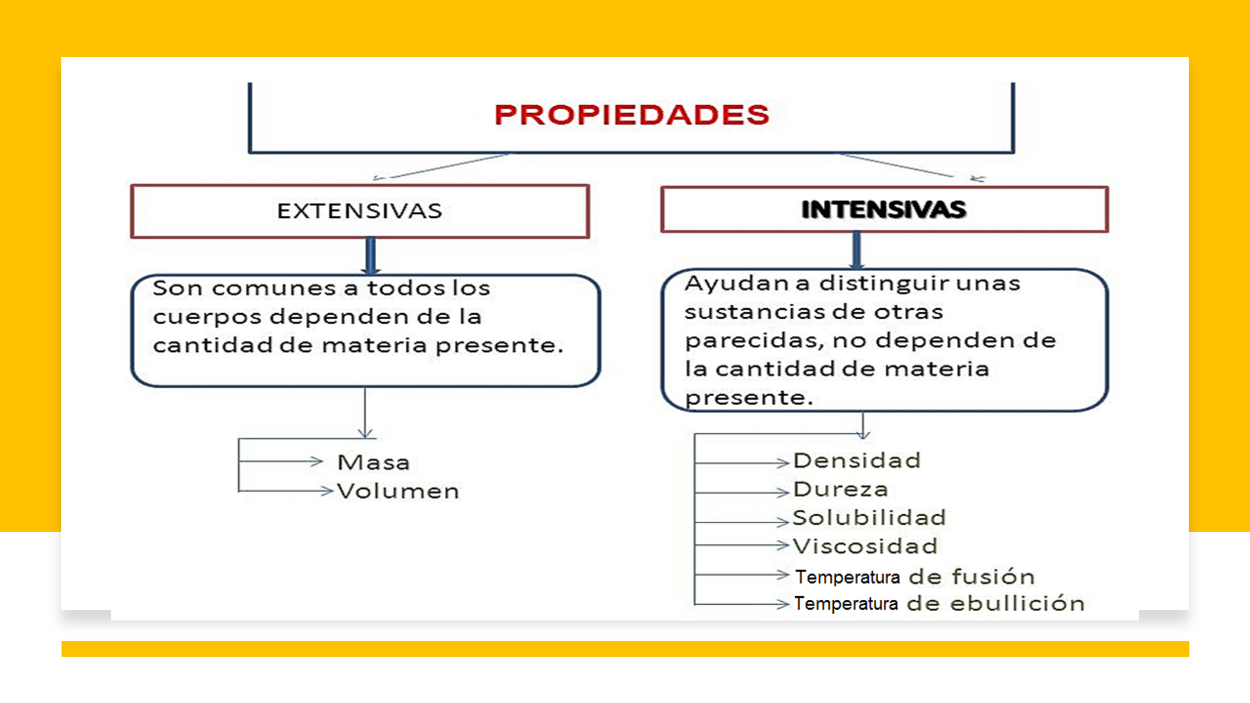
En esta sesión estudiaste algunas propiedades de los materiales. Ahora sabes que, cuando estas propiedades varían por el aumento en la cantidad de la materia, se les conoce como propiedades extensivas.
En particular, revisaste dos propiedades extensivas, la masa y el volumen.
Las propiedades que no cambian cuando hay aumento en la cantidad de materia son conocidas como propiedades intensivas. Por ejemplo, la temperatura de ebullición de 1 litro de agua es la misma que la de 10 o la de 1000 litros.
En la tabla siguiente las propiedades de la materia se encuentran clasificadas en extensivas e intensivas, toma nota de ellas.
El reto de hoy:
Incluye estos conceptos y definiciones en el Quimiglosario, expresa cada término con tus propias palabras e ilustra con dibujos, recortes y, en caso de ser posible, fotografías de manera digital.
“Apoyo educativo virtual” es un recurso didáctico de apoyo en la plataforma educativa del Instituto Politécnico Nacional, en donde podrás investigar acerca de la importancia del concepto de la materia y sus propiedades. Ahí encontrarás un apartado que contiene recursos y materiales que te ayudarán a comprender mejor los temas aquí presentados y completar tu Quimiglosario.
Puedes utilizar esta herramienta accediendo a la siguiente liga electrónica:
https://www.aev.dfie.ipn.mx/Materia_quimica/temas/tema1/subtema1/subtema1.html
¡Buen trabajo!
Gracias por tu esfuerzo.


Login to join the discussion