Rectas notables del triángulo
Valoración de la comunidad:
Última Actualización:
6 de Febrero de 2025 a las 17:22Aprendizaje esperado: explora características y propiedades de las figuras y cuerpos geométricos.
Énfasis: usar regla y compás para trazar rectas notables en un triángulo.
¿Qué vamos a aprender?
Cuando se mira hacia cualquier dirección, se identifican múltiples imágenes, objetos y situaciones que remiten a conceptos relacionados con la geometría.
Seguramente identificas formas y propiedades geométricas en la apariencia de una cancha de futbol, de basquetbol o de voleibol.
Incluso puedes notar distintas formas geométricas en tu cotidiano, por ejemplo, el aro del tablero de basquetbol o un rectángulo, tanto en una portería como en la cancha de tenis.
De este modo, se tiene por objetivo desarrollar la destreza al utilizar instrumentos geométricos para consolidar conceptos que relacionan las propiedades de muchos elementos geométricos.
Prepara tu cuaderno de notas y algunas hojas tamaño carta para los trazos, además de lápiz, goma, bolígrafos o lápices de colores, escuadras y un compás.
¿Qué hacemos?
La geometría destaca por su aplicación en la ciencia, así como en distintos casos para las matemáticas; también por la destreza que requiere para practicarla, pues incentiva una importante capacidad de razonamiento deductivo.
Los instrumentos geométricos empleados en la actualidad se han desarrollado a lo largo de los siglos.
Aunque la geometría se creó por una necesidad referente a la medición de terrenos, ha desarrollado a través de muchos años el carácter que posee como una importante herramienta basada en el razonamiento lógico deductivo.
Entonces, los aprendizajes esperados en geometría para la educación básica son los que se refieren a la geometría conocida como euclidiana.
En la actualidad, la geometría se extiende a nuevas aplicaciones más allá de las que denota su concepto: “la medida de la Tierra”. Lo anterior se hace notar en programas de geometría dinámica y diversas herramientas para el diseño gráfico.
Herramientas que han extendido la utilidad de la geometría, comparada al uso que emplearon distintas culturas en la Antigüedad.
Además, existe una influencia del razonamiento geométrico en el desarrollo de las matemáticas: la calidad del razonamiento lógico deductivo es, quizá, el mayor aporte de la geometría a las matemáticas, cuyo origen se remonta a las construcciones geométricas con regla y compás.
Pero ¿cómo se realizan estas aplicaciones?
A continuación, se presentan construcciones geométricas que describen la mediana, la mediatriz y la bisectriz en un triángulo.
Se le conoce como mediatriz a la recta perpendicular a un segmento que lo corta en su punto medio, o lo biseca, como se hace notar en el siguiente audiovisual.
-
MAT3_B5_PG2_V1_SEM32_VIDEO1
Los arcos de circunferencia en la descripción anterior representan trazos auxiliares en la construcción de la mediatriz del segmento.
Por ello, su calidad es más tenue. Sin embargo, los trazos auxiliares validan la certeza de una construcción geométrica correcta. La experiencia al practicar las construcciones permite saber que, si el radio de los arcos de circunferencia es demasiado pequeño, éstos no se intersecan.
En consecuencia, al construir las mediatrices de los tres lados de un triángulo cualquiera, se encuentran otras propiedades.
Aunque primero se ha de conocer la construcción con los instrumentos geométricos.
-
MAT3_B5_PG2_V1_SEM32_VIDEO2A
El circuncentro es el punto donde se intersecan las mediatrices de un triángulo, y su nombre se refiere a que este punto es el centro de la circunferencia circunscrita al triángulo.
En otras palabras, el circuncentro es el centro de la circunferencia que pasa por los tres vértices del triángulo.
-
MAT3_B5_PG2_V1_SEM32_VIDEO3A
La relación entre las mediatrices del triángulo, el circuncentro y la circunferencia circunscrita son útiles herramientas en la resolución de problemas, y si se desarrollan a partir de las construcciones, se favorece su comprensión.
Existen programas de geometría dinámica que permiten realizar este tipo de construcciones.
Sin embargo, las construcciones hechas con regla y compás proporcionan cierta ventaja al favorecer la consolidación de destreza y habilidades motrices que dan sentido a la relación entre los elementos geométricos.
Pero las construcciones por medio de los programas de geometría dinámica también se sustentan en los mismos principios, aunque también se debe tener una idea clara de lo que se pretende construir para introducir las instrucciones precisas y conseguir el objetivo deseado, como se plantea a continuación.
-
MAT3_B5_PG2_V1_SEM32_VIDEO4
Sea, por ejemplo, la construcción de la circunferencia circunscrita a un triángulo dado ABC.
La localización de la mediatriz de un segmento está predeterminada entre las herramientas del programa, por lo que basta indicar la acción correspondiente y señalar cada segmento para que aparezcan cada una de las mediatrices del triángulo.
En este caso, se obtiene la concurrencia en el punto, que es el circuncentro “D”.
Se selecciona la opción para construir una circunferencia con centro en el circuncentro “D” y como radio, de la distancia a cualquiera de los vértices se obtiene la circunferencia circunscrita.
Ya se presentaron las construcciones de la mediatriz y la circunferencia circunscrita a un triángulo.
Inicialmente, utilizando sólo regla y compás, y después, con un programa de geometría dinámica.
Puesto que el propósito de la sesión así lo indica, se favorecen las construcciones con regla y compás. De este modo, es indispensable tomar nota, ensayar las construcciones y realizar el siguiente análisis para una bisectriz.
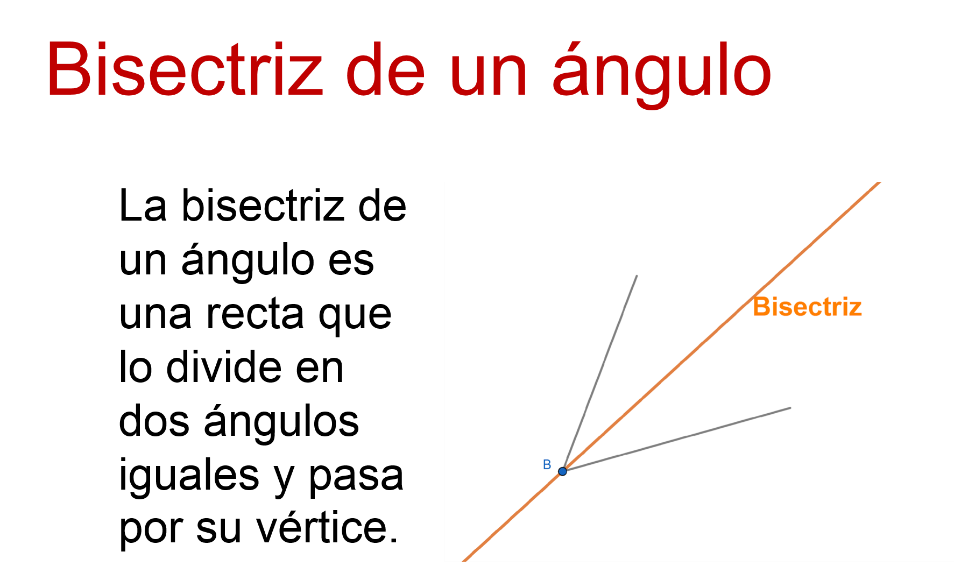
Además, puedes incorporar nuevos términos a tu acervo de conceptos matemáticos, relacionarlos con esquemas y mantener así su definición, propiedades y utilidad.
Ahora, observa el siguiente audiovisual que describe la construcción de la bisectriz de un ángulo dado.
-
MAT3_B5_PG2_V1_SEM32_VIDEO 5
Puedes ensayar la construcción de la bisectriz de distintos ángulos, como el agudo, el recto y el obtuso.
Se sabe que, si la bisectriz divide al ángulo a la mitad, o en dos ángulos iguales, también significa que todos los puntos se encuentran a la misma distancia de ambos “rayos” o lados del ángulo.
Al igual sucede con la mediatriz, en la que existen relaciones geométricas al construir las bisectrices de tres ángulos en un triángulo cualquiera, como se describe a continuación.
-
MAT3_B5_PG2_V1_SEM32_VIDEO 6ª
El incentro es el punto de intersección de las bisectrices de un triángulo.
Y su nombre se debe a que ese punto es el centro de la circunferencia inscrita en el triángulo.
-
MAT3_B5_PG2_V1_SEM32_VIDEO 7ª
La circunferencia que se genera es tangente a los tres lados del triángulo. Esto significa que la circunferencia inscrita toca en un solo punto a cada uno de los lados del triángulo.
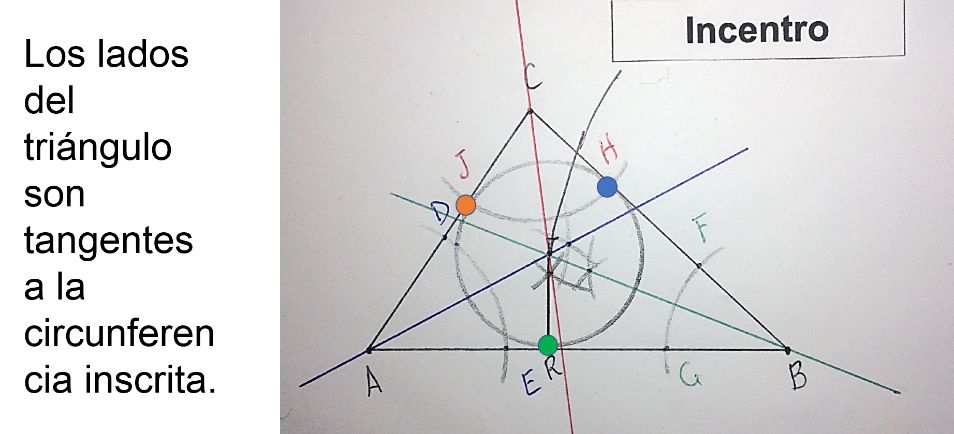
El circuncentro corresponde a la circunferencia circunscrita, y el incentro a la circunferencia inscrita en el triángulo.
Procura realizar construcciones limpias y precisas. La eficiencia del aporte que representa el despliegue de razonamientos y habilidades geométricas se adquiere de manera paulatina. Por ello, durante los años que conciernen a su educación, se incluyen contenidos geométricos que favorecen su aprendizaje y perfeccionamiento.
Esto quiere decir que los conceptos y las características que se presentan son complementarios a otros.
Por ejemplo, los ángulos entre paralelas cortadas por una transversal, la simetría, los ángulos suplementarios, la homotecia y la semejanza de triángulos, entre otros. Por estas razones, se deben asociar las propiedades descritas a los contenidos geométricos antes mencionados.
Si existe un estrecho vínculo entre la lectura de comprensión y el pensamiento lógico, ¿qué se debe hacer ante una acción geométrica?
Primero se debe entender muy bien cuál es su intención y sus condiciones. Por ejemplo, utilizar los sentidos ante situaciones que favorezcan su resolución con aprendizajes ya adquiridos.
Para demostrarlo, se tiene una lectura que expone la relación entre el pensamiento y los sentidos.


Se sabe que la literatura no es ajena a las ciencias o las matemáticas. En la lectura anterior se elogia el uso del pensamiento y de todos los sentidos. Por ello, se intuye por qué las escuelas griegas antiguas destacan la geometría: por ser un ejercicio para la razón y los sentidos.
Entonces, se puede decir que emplear los instrumentos geométricos representan una experiencia indispensable para las matemáticas.
En efecto, y esta vez se describen los atributos de las medianas de un triángulo.
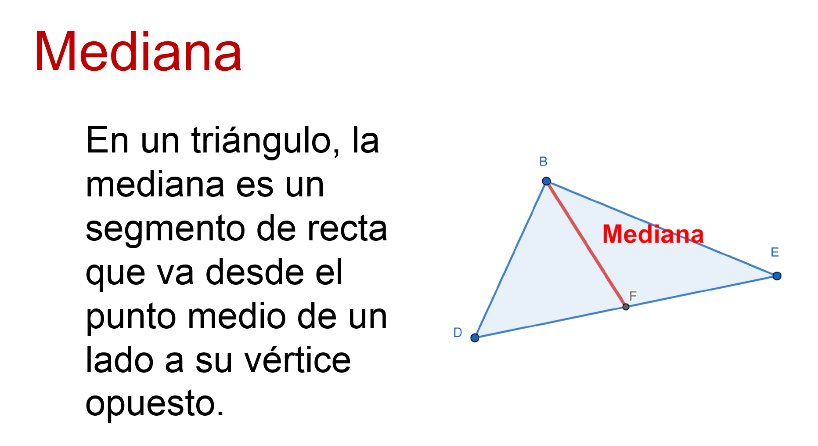
Al igual que en el caso de la mediatriz y la bisectriz, la mediana tiene ciertas características cuando se trazan en el triángulo las tres medianas correspondientes.
-
MAT3_B5_PG2_V1_SEM32_VIDEO 8
A diferencia del circuncentro y el incentro, el baricentro no es el centro de una circunferencia en particular. Sin embargo, es un punto que describe importantes propiedades.
Una de esas propiedades indica que el baricentro divide a cada mediana a los dos tercios de su longitud total.
Entonces significa que la longitud de la mediana entre el vértice y el baricentro equivale a dos tercios de la longitud total de la mediana.
Otra de las propiedades del baricentro es que se le considera el “centro de gravedad” del triángulo. Para la geometría euclidiana, el baricentro, centro de gravedad o centroide es el punto en que el triángulo alcanza el equilibrio de modo ideal.
Y para recapitular la sesión, se tiene que: conociste, a través de las descripciones, construcciones geométricas a partir de segmentos, rectas, ángulos y circunferencias. Las propiedades que se consideraron, además de promover el razonamiento lógico, son de gran utilidad al estudiar geometría analítica y trigonometría en grados posteriores.
Desarrolla tus propias construcciones. De tener la posibilidad, comparte tus observaciones con tus compañeros y tu maestra o maestro.
El reto de hoy:
Como se puede demostrar, el tiempo resulta breve al estudiar geometría, pero, en la medida de lo posible, consulta en tu libro de texto de Matemáticas los apartados relacionados a construcciones con regla y compás.
En ellos están los contenidos respecto a construcciones geométricas y sus propiedades.
Además, considera que cada vez que vuelves a leer el mismo libro, es una experiencia diferente, pues el entendimiento y tu madurez intelectual te permite comprenderlo de manera distinta.
¡Buen trabajo!
Gracias por tu esfuerzo.





Login to join the discussion