Resolución de ecuaciones de segundo grado de la forma ax2 + c = 0 despejando la incógnita
Valoración de la comunidad:
Última Actualización:
6 de Febrero de 2025 a las 17:22Aprendizaje esperado: Resuelve problemas que implican el uso de ecuaciones de segundo grado.
Énfasis: Resolver problemas que implican el uso de ecuaciones de segundo grado a través de procedimientos formales
¿Qué vamos a aprender?
Resolverás algunos problemas de ecuaciones de segundo grado, relacionados con la vida diaria, por medio de procedimientos formales: como la propiedad uniforme y la propiedad de cancelación.
Es muy importante, que tomes notas, para una mejor comprensión del tema.
¿Qué hacemos?
Inicia, con un poco de historia de las matemáticas, con una pequeña lectura:

Piensa en las siguientes situaciones de la vida diaria:
Sin duda, estos son algunos ejemplos de situaciones de comportamiento cuadrático, que se pueden modelar en una ecuación de segundo grado:

Observa cómo resolver un problema

Ayuda a Paty a encontrar la medida de cada lado y el perímetro de la figura.

Estos pasos no solo te servirán para resolver este problema, sino que los puedes utilizar para resolver cualquier problema de ecuaciones de segundo grado.
Primero tienes que analizar toda la información que contiene el problema, para obtener los datos más útiles para la resolución del mismo:
El terreno de Paty es un rectángulo cuya área es:
A = 28
m
2

se desea calcular su perímetro
Sabes que la fórmula de área del rectángulo es
A=(base)(altura)
Base= x-6 y altura= x + 6
Es importante que identifiques en el esquema la información que te ayudará a resolver el problema.







Pudiste observar que, de un problema sencillo y cotidiano se derivó una ecuación de segundo grado.
Existen muchas situaciones en tu entorno que puedes plantear en una ecuación de segundo grado para modelarla y resolverla. Observa cómo puedes resolver otro ejemplo de situación muy cotidiana:

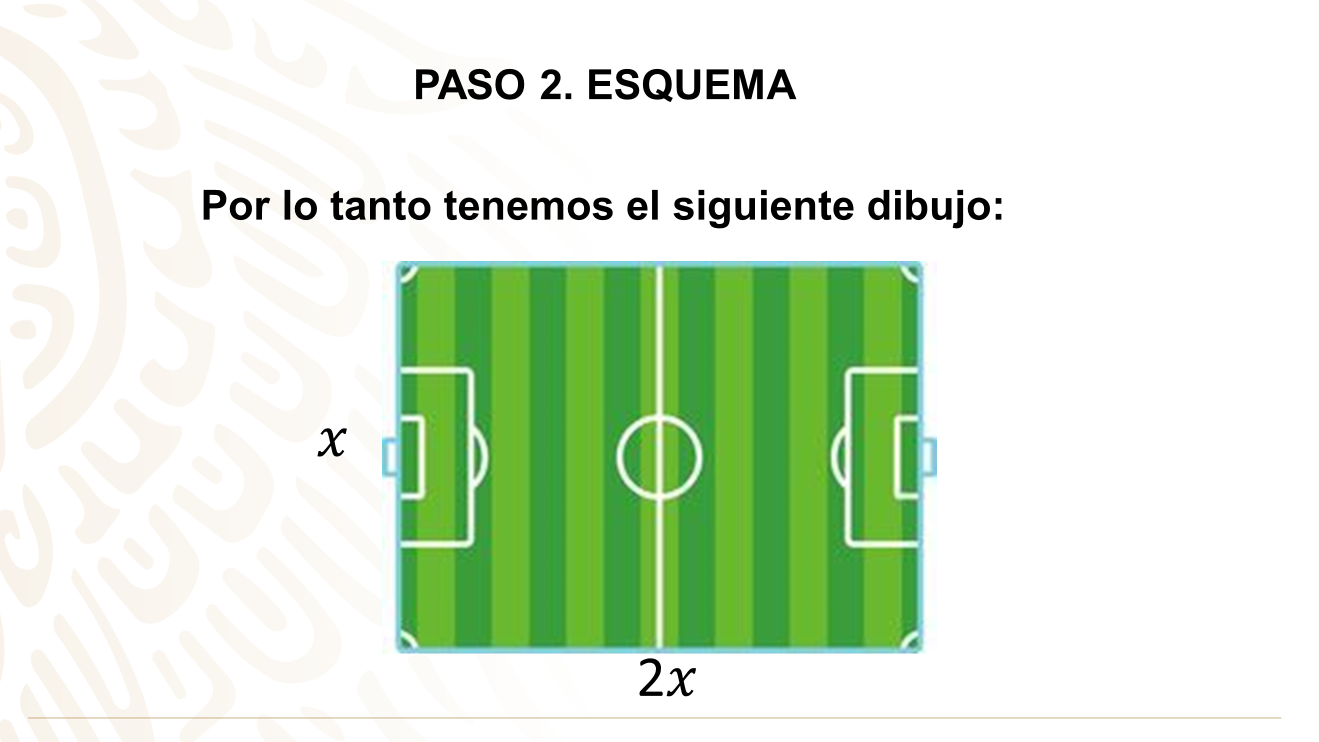




Analiza la siguiente situación:

Entonces tienes que el ring, que es un cuadrado de lado X, donde el área de luchas se tomará como 36 m2.


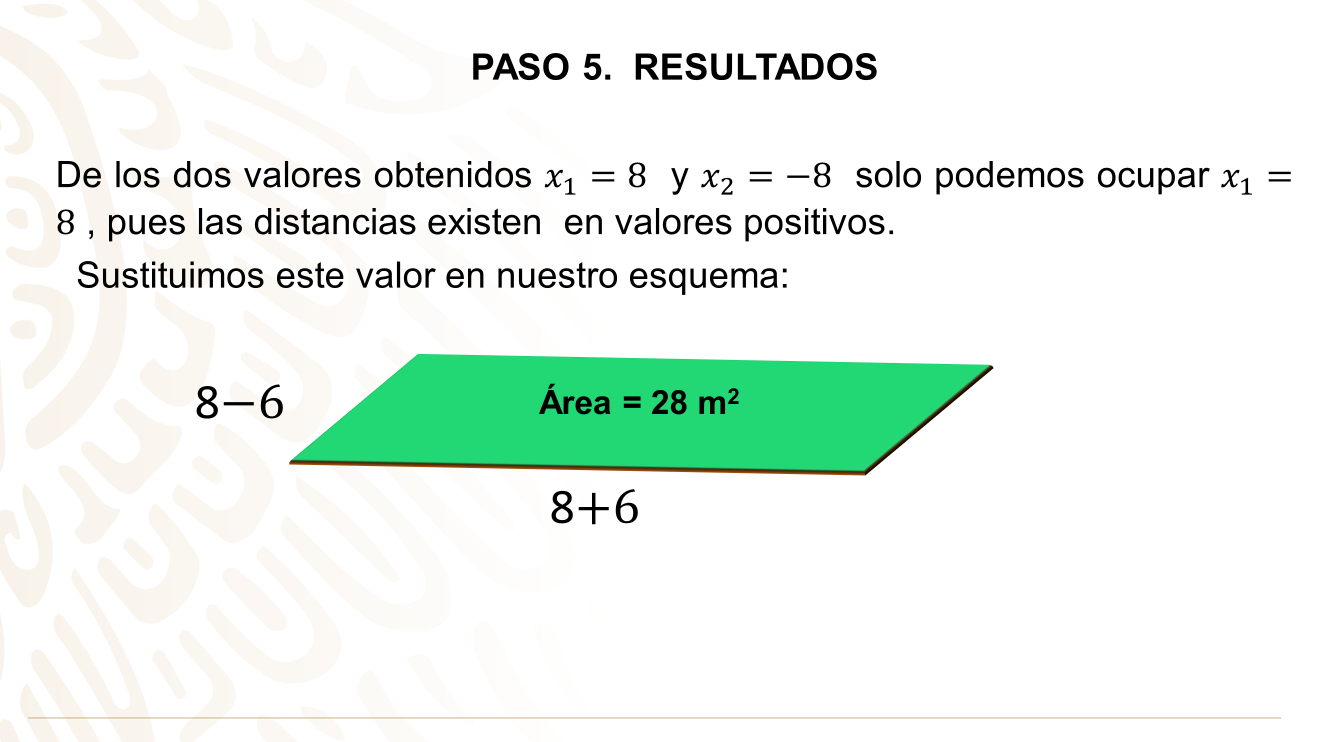
Paso 5. Resultados
X= 6
El lado del ring de lucha libre es de 6 m, entonces:
(6)(6) = 36 m2
El Reto de Hoy
Puedes buscar en tu libro de texto otras situaciones o problemas que te permitan plantear una ecuación de segundo grado.
Resuelve la siguiente ecuación:
X2 + 12 = 37
Descarga tu clase dando click aquí
¡Buen trabajo!
Gracias por tu esfuerzo.








Login to join the discussion