¿Cómo los resolvemos?
Valoración de la comunidad:
Última Actualización:
6 de Febrero de 2025 a las 17:20
¿Cómo los resolvemos?
Aprendizaje esperado: reconoce la importancia de recabar información sobre los antecedentes de un problema para resolverlo.
Énfasis: explorar problemas sociales.
¿Qué vamos a aprender?
Profundizarás en el conocimiento de los diversos problemas que afectan a la sociedad y también para sensibilizarte y colaborar para buscar una solución.
En las comunidades, colonias y pueblos existen diversos tipos de problemas que muchas veces afectan como sociedad; para la búsqueda de soluciones es necesario indagar acerca de aquellos que se presentan en tu comunidad.
Los materiales que necesitarás son tu cuaderno y lápiz o bolígrafo para tomar notas, también ten a la mano tu libro de texto.
No olvides que todo lo que aprendas es para fortalecer tu conocimiento; se te recomienda llevar un registro de las dudas, inquietudes o dificultades que surjan durante la sesión, pues muchas de éstas las podrás resolver al momento de consultar tu libro de texto y revisar tus apuntes.
¿Qué hacemos?
Lee la siguiente situación:
En la colonia en la que vivo hay escasez de agua, todos estamos sufriendo y tratando de ahorrar el agua para todo lo que se necesita, que, como usted sabe, son muchas las actividades que dependen del agua.
Ya me imagino que están padeciendo, además de que es muy complicado no tener agua, pues el agua es vital e indispensable para nuestra vida y para las diferentes actividades diarias: lavar trastes, ropa, bañarnos, preparar los alimentos, por mencionar algunas.
Y más aún porque no sólo afecta a una sola persona, sino a toda la colonia en la que vivo.
El problema por el que pasan las personas de esa colonia es un PROBLEMA SOCIAL.
En esta sesión aprenderás lo que es un problema social, cómo identificarlo, qué información recabar, pero, sobre todo, qué puedes hacer para ayudar a tu comunidad.
Observa el siguiente video en el que se muestra cómo un grupo de jóvenes participan en dar solución a un problema de una comunidad. Obsérvalo del inicio al minuto 04:05.
- Nuestra participación cuenta
https://www.youtube.com/watch?v=rOOnyu1goJM
Un problema es un asunto o cuestión que se debe solucionar o aclarar; un conflicto entre lo que es y lo que debe ser.
Existen infinidad de problemas, pero cada uno es diferente.
Los problemas diarios pueden ser, perder las llaves de tu casa, problemas matemáticos o cuando no encuentras tu celular, por ejemplo.
Esos son otro tipo de problemas que requieren otro tipo de soluciones. Por ejemplo, se tienen problemas más serios, como, imagina que algún familiar no tuviera dinero para sostener a su familia, o que algún conocido no pueda estudiar por falta de recursos.
Pero existen problemas que afectan a muchas personas y, cuando esto sucede, entonces se habla de un problema que afecta a la sociedad.
Entonces se puede decir que un problema social es toda aquella circunstancia que afecta negativamente las condiciones de vida de una comunidad, y que es provocada por las acciones que cometen determinadas personas, o bien por otras causas, como fenómenos de la naturaleza.
Imagina en varios problemas sociales, y no sólo en tu comunidad, sino también en todo el país y el mundo.
Efectivamente, hay problemas generales y también muchas soluciones, pero antes de participar en la solución de un problema social, debes investigar; primero necesitas identificar los diferentes tipos de problemas, para ello, analizarás sus características.
Las características que tienen los problemas sociales son:
Primero es que afectan a un gran número de personas. Una situación se convierte en problema cuando la cantidad de gente afectada es considerablemente alta. Este factor lo diferencia de los problemas individuales y los grupales.
Otra característica son los efectos perjudiciales. Éstos se dejan sentir cuando los gobiernos parecen rebasados para controlarlos de manera efectiva.
Otra más es que tienen solución. La solución muchas veces exige voluntad política y de la sociedad, pero será más efectiva a través de una acción conjunta y colectiva.
Y finalmente se tiene que se modifican con el tiempo.
Realiza una lista con los problemas sociales que conoces.
Algunos de los problemas podrían ser:
- El consumo de tabaco a edades tempranas
- La escasez de agua
- La acumulación de basura
- La delincuencia
Ahora lee la lista de los principales problemas de comunidades: - Contaminación de ríos, lagunas y presas
- Falta de escuelas y material educativo
- Discriminación sexual
- Desempleo
Es posible que los problemas que escribiste coincidan con algunos de la lista.
Pero ¿cómo puedes indagar más acerca de estos u otros problemas sociales?
Lo que puedes hacer es preguntar con tus familiares o conocidos acerca de los problemas que hay en tu comunidad, ellos te darán los primeros elementos y, para indagar más a fondo, en Internet o en libros.
Seguramente has escuchado sobre un problema que afecta no sólo a tu comunidad, sino a todo el mundo y es la violencia.
También en la comunidad escolar se tienen diversos problemas como el bullying que, de igual manera, no sólo se vive en las instituciones educativas, también en otros ámbitos.
Otro recurso de investigación es: La observación para conocer el problema.
Para analizar un problema mediante la observación se requiere de una guía con puntos específicos que permitan conocer los datos más relevantes y de esta manera encontrar la información que estás buscando.
Entonces, podrías observar tu entorno y reconocer los aspectos que no funcionan bien o que podrían mejorarse. Por ejemplo, otro de los problemas comunes es la basura.
Hacer un recorrido por tu comunidad ayuda para poder identificar los problemas. También revisar las noticias locales en televisión, radio o periódicos.
Y, por supuesto, conversar con personas de la localidad, amigos, familiares o vecinos.
Podrías recurrir a las entrevistas, ya que es otro recurso de investigación.
Cuando sabes quiénes son las personas expertas o que conocen el problema, la entrevista se convierte en un recurso valioso para obtener información.
Al igual que todas las entrevistas, para llevarla a cabo se requiere de un guion de preguntas.
Para saber más del tema, observa el siguiente video del inicio al minuto 01:48.
- Entrevistar a alguien de la localidad
https://www.youtube.com/watch?v=K1Wo1xX5JXs
Es un buen recurso para obtener información del problema que deseas investigar.
Otro recurso que también puede ser de mucha utilidad, son las encuestas como recurso para sondear la población.
Cuando se necesita conocer la respuesta de muchas personas, la encuesta es un recurso valioso. Requiere de un cuestionario, la definición de una muestra y del análisis de los resultados obtenidos. Esto conlleva tareas que deben realizarse previamente a su aplicación, por ejemplo:
- Determinar qué se necesita saber del problema.
- Plantear preguntas acerca de la información que se desea obtener.
- Definir a quiénes se va a encuestar.
- Elaborar el cuestionario para la encuesta.
- Pedir apoyo e invitar a los vecinos o a la sociedad en general a ser encuestados.
Como te diste cuenta, tienes estos recursos que te ayudarán a obtener más información y revisar a fondo el problema social que quieres investigar. Obviamente existen más, pero éstos te serán muy útiles.
Considera que pueden ser otros, no sólo los mencionados; lo relevante es saber cuáles son los más adecuados para tu propósito.
Es importante conocer estas diversas herramientas para obtener información, pero ¿dónde o a quién puedes entrevistar o encuestar?
Eso dependerá mucho del problema que quieras atender, hay muchas instancias a las que puedes recurrir.
Por ejemplo, sí tu problema es la acumulación de basura, puedes entrevistar o encuestar a las personas que viven en esa localidad, ellos tendrán información de manera personal, pues están viviendo ese problema.
También podrías preguntar al alcalde o a la autoridad de la comunidad para saber qué está sucediendo.
Ellos proporcionarían información muy útil. Recuerda que la información que obtengas tendrá que ser procesada posteriormente, por lo que es importante tener mucha claridad sobre lo que quieres saber.
Puedes elaborar un cuestionario que te ayude a delimitar tu investigación, por ejemplo:
- ¿Qué problemas sociales hay en la comunidad?
- ¿Cuál de ellos debe resolverse y por qué?
- ¿De qué tipo son: ambientales, salud, inseguridad?
- ¿Desde cuándo ocurre el problema?
- ¿De qué forma esos problemas afectan directamente?
- ¿Qué podrían proponer los ciudadanos?
- ¿A quién se puede recurrir para obtener más información y ayuda?
Después de haber aplicado el cuestionario, puedes registrar las respuestas de los encuestados en un cuadro como el siguiente.
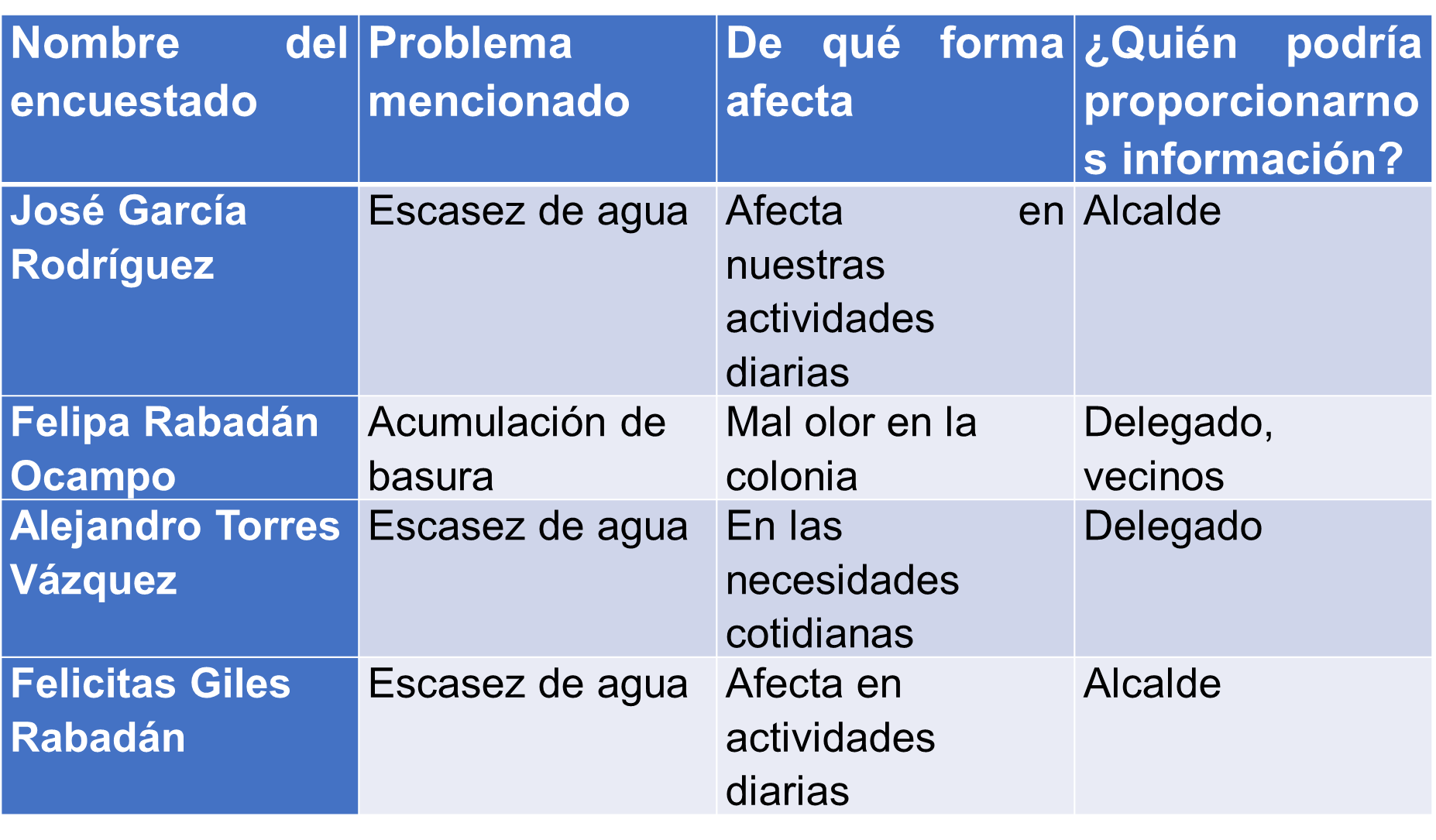
En la primera columna tienes a las personas que te ayudaron a responder el cuestionario, en la segunda se encuentra el problema que has observado o tienen en tu comunidad, en la tercera columna, de qué forma afecta y en la última, quién podría brindar información.
De esta manera puedes identificar, de una forma más rápida, los problemas que afectan a los miembros de la localidad y así saber cuáles son los prioritarios de atender.
Aunque existen problemas que no sólo afectan a tu colonia, sino también a todo nuestro país y a todo el mundo. Considera que cada problema social puede adquirir diferentes características dependiendo del lugar donde se presenta, por ejemplo, el desempleo en México y Cuba cobra una dimensión diferente con relación a otros países como Estados Unidos y China.
Por ejemplo, regresando al tema de la escasez de agua en tu localidad, los recursos hídricos en México son escasos para abastecer a toda la población del país. Se calcula que más de 12 millones de personas no tienen acceso al agua o es de muy mala calidad.
Esto ha generado que se tenga que recurrir al consumo de agua embotellada, lo que supone un gasto en la economía familiar y un problema medioambiental por el exceso del uso de plástico.
Otro problema social que se podría mencionar sería el analfabetismo, que a pesar de que la educación básica en México es gratuita, en muchos estados los jóvenes no pueden asistir a la escuela.
Esto lleva a que las tasas de analfabetismo en el país sean altas, y que muchas personas mayores de 15 años no han tenido la oportunidad de aprender a leer ni escribir.
Se calcula que el porcentaje de personas analfabetas mayores de 15 años abarca casi 6% de la población mexicana. Esto quiere decir que casi cinco millones de personas no saben leer ni escribir, de acuerdo con el Censo 2020 realizado por el Instituto Nacional de Estadística y Geografía (INEGI).
En relación a este tema, las mujeres se encuentran en una situación de desventaja con respecto a los hombres.
Otro problema en el que se debe poner atención es la explotación infantil.
Históricamente, este problema ha afectado al continente americano de forma generalizada. México no es la excepción y se calcula que 4 millones de niños menores de 17 años se encuentran trabajando. Además, un millón son menores de 14 años; esto quiere decir que se encuentran trabajando de forma ilegal de acuerdo a lo estipulado en la Ley Federal del Trabajo.
La población infantil trabajadora en México se encuentra localizada principalmente en áreas rurales; las mujeres son las encargadas de ejercer quehaceres domésticos, y los hombres, dedicados a trabajar en tareas del campo.
El acceso a la salud. En México, el área sanitaria depende de diferentes instancias como los hospitales de la Secretaría de Salud, el Instituto Mexicano del Seguro Social, el Instituto de Seguridad y Servicios Sociales de los Trabajadores del Estado.
Sin embargo, la cobertura universal está lejos de alcanzarse. Todavía existen millones de personas que no tienen acceso a la sanidad pública.
Como pudiste darte cuenta, se mencionaron algunos problemas sociales que existen en nuestro país, también del entorno local, y diversos de la comunidad. De esta manera, tienes un panorama de los que afectan a la sociedad.
También te percataste de que, dependiendo del lugar, los problemas son diferentes, por ejemplo, los de contaminación de ríos, lagunas y presas.
Investiga acerca de estos problemas que se acaban de mencionar, o en otros que identifiques en el contexto en que se desenvuelven.
A lo largo de la historia, los problemas sociales han sido parte de ella. Con el pasar del tiempo, estos problemas han ido cambiando y evolucionando, pero nunca han dejado de existir.
Actualmente, la principal fuente para obtener información acerca de ellos es internet, sin embargo, debes saber navegar. Antes de iniciar con la búsqueda, debes preguntarte qué quieres investigar, cuál es el tema del que te interesaría informarte y para qué quieres investigar, es decir, los objetivos de la búsqueda.
También puedes investigar en libros, revistas, enciclopedias; cuando se trate de un problema que implica una investigación más amplia, puedes buscar en plataformas especializadas o de las secretarías de Estado, instituciones públicas, de organizaciones civiles, o bien en ministerios de otros países, todo dependerá del problema que deseas investigar, pero, sobre todo, de cómo contribuir a su solución.
Usa los recursos como la observación, la entrevista y las encuestas.
No olvides leer, subrayar lo más relevante; rescata ideas principales y secundarias, y transcribe la información.
El reto de hoy:
Elabora una lista de los problemas que afecten a tu comunidad, después selecciona uno y busca información referente a ese problema y las posibles alternativas de solución.
Recuerda siempre poner en práctica todo lo aprendido en esta sesión, puedes guiarte con tus notas, libros e incluso tener un diálogo con tus padres con respecto a lo visto en la sesión, de tal manera que el aprendizaje obtenido esté siempre en movimiento y así afianzarlo.
¡Buen trabajo!
Gracias por tu esfuerzo.












Login to join the discussion